-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Má věk nemocných s chronickou myeloidní leukemií při léčbě imatinibem vliv na dosaženou léčebnou odpověď?
Impact of age on the clinical response of patients with CML treated with imatinib
Introduction:
Treatment of chronic myeloid leukemia (CML) with tyrosine kinase inhibitors (TKI) has significantly changed the survival of patients of all age categories. In our work, we have tried retrospectively to analyze a therapeutic response and toxicity of imatinib according to age of patients (≤ 60 years vs > 60 years). Patients have started treatment with imatinib in 2001–2013 in our department. The duration of treatment was at least 18 months.Patients and methods:
The whole group contains 103 patients (52 women, 51 men) with a median age at diagnosis of CML 55 years (range 19–88 years). The first group includes 68 the younger patients (31 women, 37 men) with a median age at diagnosis 43 years (range 19–59 years) and the second group 35 the elderly patients (21 women, 14 men) with a median age at diagnosis 70 years (range 61–86 years). Median imatinib dose in both groups was the same – 400 mg per day (range 200–600 mg).Results:
In the elderly patients we observed higher rates of hematological toxicities (p = 0.0059). After 12 months treatment, a complete cytogenetic response (CCyR) was achieved in 90 % of younger patients and in 74 % of the elderly patients, respectively. Major molecular response (MMR) at 18 months treatment was achieved in 79 % of the younger group and in 63 % of the elderly group.Conclusion:
The results represent in both groups very good therapeutic response independent of age of patients at the time of CML diagnosis.Key words:
age – chronic myeloid leukemia – imatinib – therapy
Autoři: Petra Bělohlávková; Jaroslava Voglová; Jakub Radocha; Pavel Žák
Působiště autorů: IV. interní hematologická klinika LF UK a FN Hradec Králové, přednosta doc. MUDr. Pavel Žák, Ph. D.
Vyšlo v časopise: Vnitř Lék 2015; 61(9): 785-791
Kategorie: Původní práce
Souhrn
Úvod:
Léčba chronické myeloidní leukemie (CML) tyrozinkinázovými inhibitory (TKI) výrazně ovlivnila přežití nemocných všech věkových kategorií. V naší práci retrospektivně analyzujeme dosaženou léčebnou odpověď a toxicitu léčby imatinibem podle věku pacientů (≤ 60 let vs > 60 let). Tito nemocní na našem pracovišti zahájili léčbu imatinibem v letech 2001–2013 a léčba trvala minimálně 18 měsíců.Pacienti a metodika:
Celý soubor představuje 103 pacientů (52 žen, 51 mužů) s mediánem věku v době diagnózy CML 55 let (rozpětí 19–88 let). Skupina mladších pacientů zahrnuje 68 pacientů (31 žen, 37 mužů) s mediánem v době diagnózy 43 let (rozpětí 19–59 let) a skupinu starších pacientů tvoří 35 pacientů (21 žen, 14 mužů) s mediánem věku v době diagnózy 70 let (rozpětí 61–86 let). Medián dávky imatinibu byl v obou skupinách shodný 400 mg denně (rozpětí 200–600 mg).Výsledky:
V průběhu léčby jsme pozorovali ve skupině starších pacientů vyšší četnost výskytu hematologické toxicity (p = 0,0059). Po 12 měsících léčby bylo dosaženo kompletní cytogenetické odpovědi (CCyR) u 90 % mladších pacientů a u 74 % starších pacientů, velké molekulární odpovědi (MMR) po 18 měsících léčby bylo dosaženo u 79 % mladších pacientů a 63 % starších pacientů.Závěr:
Tyto výsledky představují v obou skupinách velmi dobrou léčebnou odpověď bez vlivu věku v době diagnózy na dosažení této odpovědi.Klíčová slova:
chronická myeloidní leukemie – imatinib – léčba – věkÚvod
Chronická myeloidní leukemie (CML) patří do skupiny klonálních myeloproliferativních nemocí a toto onemocnění je charakterizováno přítomností Philadelphského chromozomu (Ph), který je výsledkem translokace mezi chromozomy 9 a 22 se vznikem fúzního genu BCR-ABL1. Konstitutivně aktivovaná tyrozinkináza, která je tímto genem kódována, je zodpovědná za nekontrolované množení krvetvorných buněk a rozvoj choroby. CML představuje 15–20 % leukemií dospělých a medián výskytu CML byl uváděn mezi 50–55 lety. Z databází národních onkologických registrů a klinických databází však vyplývá, že aktuální medián věku v době diagnózy CML se pohybuje mezi 60–65 lety. Naopak do studií jsou zařazováni nemocní s věkem v době diagnózy CML o 10 let a více nižším [2]. Incidence onemocnění se pohybuje od 1–1,5 nového případu na 100 000 obyvatel za rok. Medián přežití CML bez léčby byl uváděn mezi 2–3 lety, při paliativní léčbě hydroxyureou 4 roky, při léčbě interferonem se přežití pohybovalo kolem 6 let [1].
Objev tyrozinkinázových inhibitorů (TKI) představoval převrat v léčbě pacientů s CML a současně výrazně zlepšil prognózu pacientů [3,4]. V současné době se domníváme, že očekávaná střední doba přežití nemocných léčených TKI je kolem 25 let. Pro léčbu CML je od roku 2001 v ČR v první linii užíván imatinib. Od roku 2010 máme k dispozici pro pacienty, kteří jsou k léčbě imatinibem rezistentní nebo imatinib netolerují, preparáty 2. generace TKI (nilotinib, dasatinib) a nilotinib lze již v ČR použít i jako lék první linie. V roce 2012 byl schválen k léčbě CML další zástupce ze skupiny TKI 2. generace – bosutinib, v témže roce byl schválen rovněž ponatinib jako představitel 3. generace TKI. Tyto preparáty však nejsou u nás standardně k dispozici, jejich použití je možné pouze v individuálních případech při vyčerpání všech ostatních léčebných možností CML po schválení úhrady.
Výslednou léčebnou odpověď u pacienta ovlivňuje celá řada faktorů, které zahrnují pacienta (věk, komorbidity, kompliance, performance status), chorobu (fáze onemocnění, prognostické rizikové skóre, farmakokinetika) a léčbu CML (výběr TKI, nutnost přerušování léčby, nežádoucí účinky a jejich řešení) [5,8,9]. Je známo, že pacienti ve studiích s CML zpravidla bývají mladší a bez větších komorbidit, než je reálná skupina pacientů. Na našem souboru pacientů jsme retrospektivně analyzovali dosaženou léčebnou odpověď a toxicitu léčby v reálné praxi s ohledem na věk pacienta v době stanovení CML. Snažili jsme se rovněž posoudit přínos a rizika léčby starších nemocných.
Soubor
V analyzovaném souboru je hodnoceno 103 pacientů (52 žen, 51 mužů) s mediánem věku celého souboru v době diagnózy CML 55 let (rozpětí 19–88 let), u nichž léčba imatinibem trvala minimálně 18 měsíců (M) z důvodu možnosti hodnocení molekulární odpovědi. Tito nemocní na našem pracovišti zahájili léčbu imatinibem od roku 2001 do konce června roku 2013.
Z tohoto souboru u 12 pacientů (11 %) předcházela léčba interferonem. Pacienti byli podle věku v době diagnózy rozděleni do 2 skupin: skupina mladších pacientů s věkem v době diagnózy ≤ 60 let zahrnuje 68 pacientů (31 žen, 37 mužů) a skupinu starších pacientů s věkem v době diagnózy > 60 let představuje 35 pacientů (21 žen, 14 mužů). Rozdělení podle fáze CML v době diagnózy, podle prognostického rizikového skórovacího systému (Sokalův a Hasfordův index) u chronické fáze CML [3,4] a podle celkového stavu nemocných dokumentuje tab. 1. V této hodnocené skupině měli pouze 3 starší nemocní v době diagnózy akcelerovanou fázi CML. U dalších 3 starších nemocných se akcelerovaná fáze CML rozvinula v období od diagnózy CML do zahájení léčby imatinibem.
Tab. 1. Charakteristika souboru pacientů 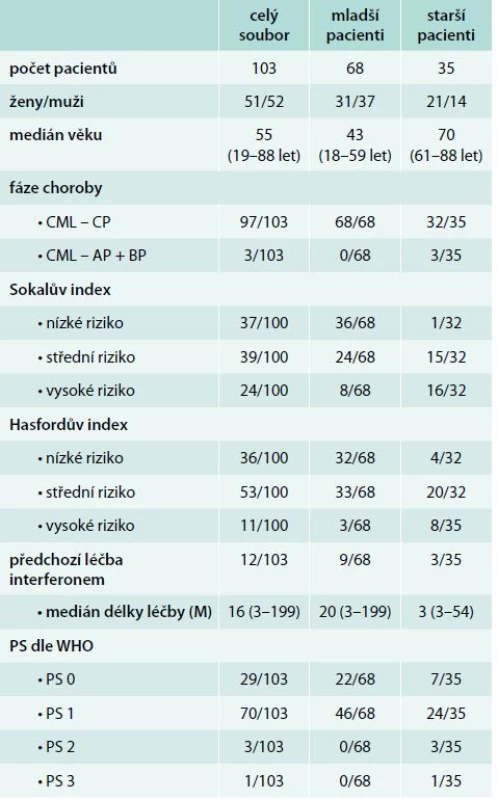
Do našeho souboru nebyli zahrnuti mladší pacienti, kteří pro rizikovost onemocnění (pokročilé fáze CML) byli již primárně směřováni k alogenní transplantaci kostní dřeně nebo byli léčeni v první linii TKI 2. generace v rámci klinických studií. Dále do analýzy nebyli zahrnuti nemocní, u nichž pro primární rezistenci na imatinib nebo léčebnou toxicitu bylo nutné časné provedení léčebné změny, tedy ještě před 18 měsících léčby, a nebylo by možné hodnocení molekulární odpovědi.
Metodika
Hodnocení optimálních léčebných odezev je v našem souboru provedeno na základě doporučení Evropské leukemické skupiny (ELN) z roku 2009, neboť jsou retrospektivně hodnoceni pacienti se zahájením léčby do června roku 2013, kdy tato léčebná doporučení byla v platnosti [8,9]. Ve 3. měsíci léčby je hodnoceno dosažení kompletní hematologické odpovědi (CHR), které je charakterizováno počtem trombocytů < 450 × 109/l, počtem leukocytů < 10 × 109/l, chyběním mladších forem leukocytů a počtem bazofilů < 5 % v krevním obraze a periferním nátěru. Současně při klinickém vyšetření není hmatná slezina. Cytogenetická odpověď je hodnocena na základě počtu zachycených Ph+ mitóz ve dřeni při hodnocení klasickou cytogenetickou metodou. Kompletní cytogenetická odpověď (CCyR) je definována jako nepřítomnost Ph+ mitóz ve dřeni a dle ELN kritérií 2009 by u nemocných s CML měla být dosažena ve 12. měsíci léčby. Molekulární odpověď a její hloubka je posouzena podle výsledku měření hladiny transkriptu BCR-ABL1, k jehož stanovení se používá kvantitativní polymerázová řetězová reakce s využitím reverzní transkriptázy (RT-PCR). Výsledek je vyjádřen jako poměr BCR-ABL1 k ABL (či jinému kontrolnímu genu) × 100 % a je převeden na mezinárodní škálu (IS). Velká molekulární odpověď (MMR) je stanovena jako hodnota BCR-ABL1/kontrolní gen ≤ 0,1 % a podle ELN kritérií z roku 2009 by měla být dosažena po 18 měsících léčby pacientů s CML. Ke statistickému zhodnocení rozdílů v obou skupinách byl použit Fisher exact test a hodnota p < 0,05 byla považována za statisticky významnou. K hodnocení přežití byla použita Kaplanova-Meierova metoda.
Výsledky
V našem analyzovaném souboru 12/103 (11 %) pacientů zahájilo v době diagnózy CML léčbu interferonem s mediánem trvání této léčby v celém souboru 16 měsíců (3–199 M). Jednalo se o 9/68 (29 %) pacientů ze skupiny mladších a 3/35 (8 %) ze skupiny starších pacientů, kteří byli diagnostikováni před rokem 2001. Z této skupiny nemocných 6/12 (50 %) dosáhlo při léčbě CHR, avšak pouze v jednom případě bylo dosaženo CCyR, v žádném případě nebylo dosaženo MMR. Při selhání léčby interferonem u těchto nemocných byla zahájena léčba imatinibem v dávce 400 mg denně. U 91 pacientů (88 %) byla na našem pracovišti od roku 2001 již primárně zahájena léčba imatinibem 400 mg denně s případnými úpravami dávky podle léčebné toxicity. Výsledný medián denní dávky imatinibu v celém souboru, ale i v obou hodnocených skupinách je 400 mg denně (rozpětí 200–600 mg denně).
Z podrobnější analýzy však zjistíme, že ve skupině starších nemocných z důvodu toxicity dlouhodobě užívá nižší dávku imatinibu 9/35 pacientů (26 %): 7 pacientů 200 mg, 2 pacienti 300 mg denně oproti skupině mladších pacientů, kde pouze 2/68 (3 %) pacientů užívá nižší dávku (300 mg imatinibu denně). Tato skutečnost je dána léčebnou toxicitou imatinibu s nutností redukce dávky. Ve skupině starších nemocných je přítomna vyšší hematologická toxicita ve smyslu rozvoje trombocytopenie (14 % grade 1 a 2, 6 % grade 3 a 4 u starších vs 10 % a 0 % u mladších). Z nehematologické toxicity byl pozorován u starších nemocných vyšší výskyt gastrointestinálních potíží (23 % vs 7,5 %), tab. 2. Ze statistického hodnocení vyplývá, že rozdíl ve výskytu hematologické toxicity ve skupině starší vs mladší je statisticky významný (p = 0,0059), ale rozdíl ve výskytu nehematologické toxicity statisticky významný není (p = 0,1347).
Tab. 2. Léčebná toxicita v souboru 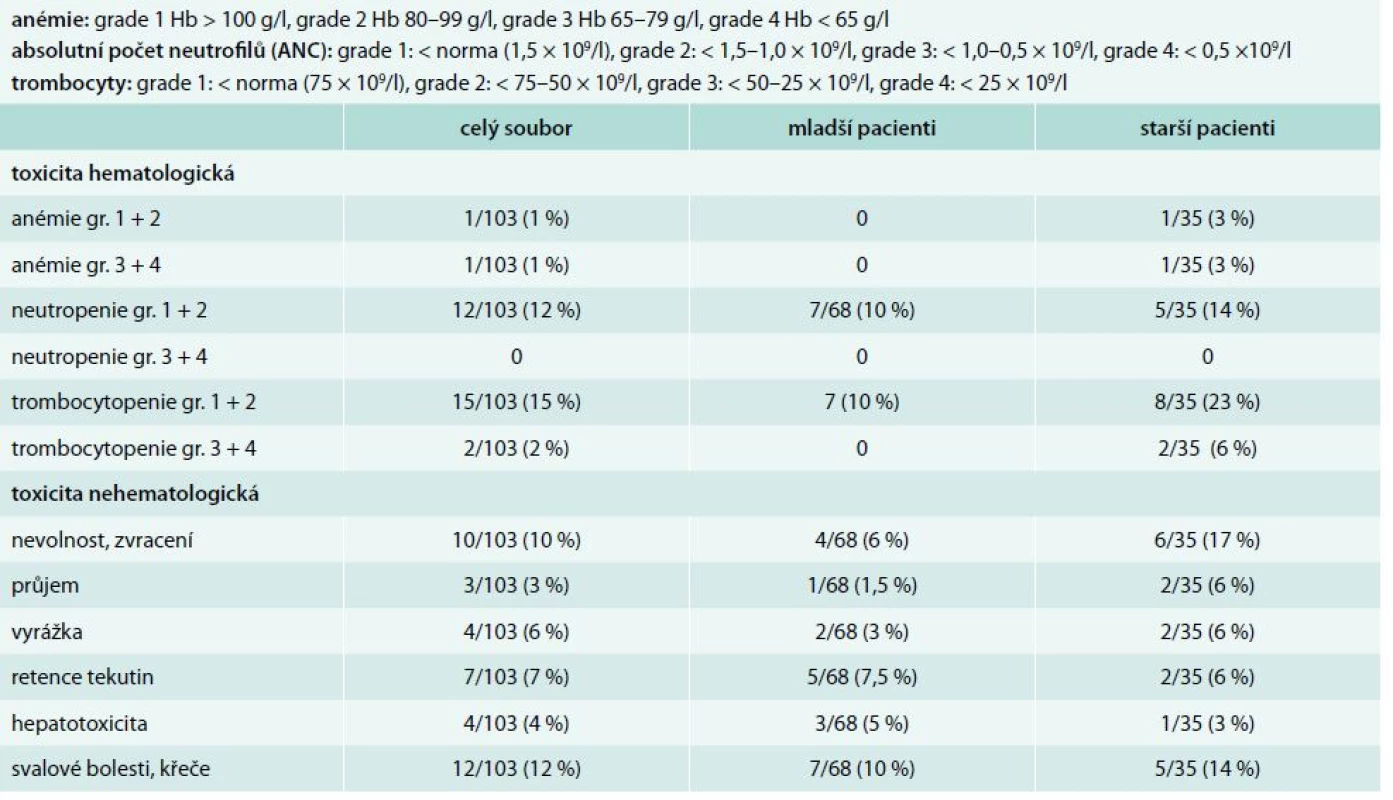
Kompletní hematologické odpovědi (CHR – complete hematologic response) ve 3. měsíci léčby dosáhlo ve skupině starších pacientů 28/35 pacientů (80 %) a ve skupině mladších 66/68 pacientů (97 %). Po 12 měsících léčby byla přítomna CCyR u 26/35 starších pacientů a 61/68 mladších pacientů (74 % vs 90 %). Po 18 měsících léčby při hodnocení MMR této odpovědi dosáhlo 22/35 starších pacientů a 54/68 mladších pacientů (63 % vs 79 %), tab. 3, graf 1. V případě statistického posouzení dosažených odezev bylo zjištěno, že význam věku na dosaženou odpověď se uplatňuje pouze ve 3. měsíci na dosažení CHR (p = 0,0068). V naší analýze jsme nepotvrdili vliv věku na dosažení CCyR po 12 měsících léčby (p = 0,1378) ani na dosažení MMR po 18 měsících léčby imatinibem (p = 0,0974).
Graf 1. Dosažení jednotlivých odpovědí ve skupině starší vs mladší pacienti 
CHR – kompletní hematologická remise CCyR – kompletní cytogenetická remise MMR – velká molekulární odpově Tab. 3. Léčebné odpovědi v souboru 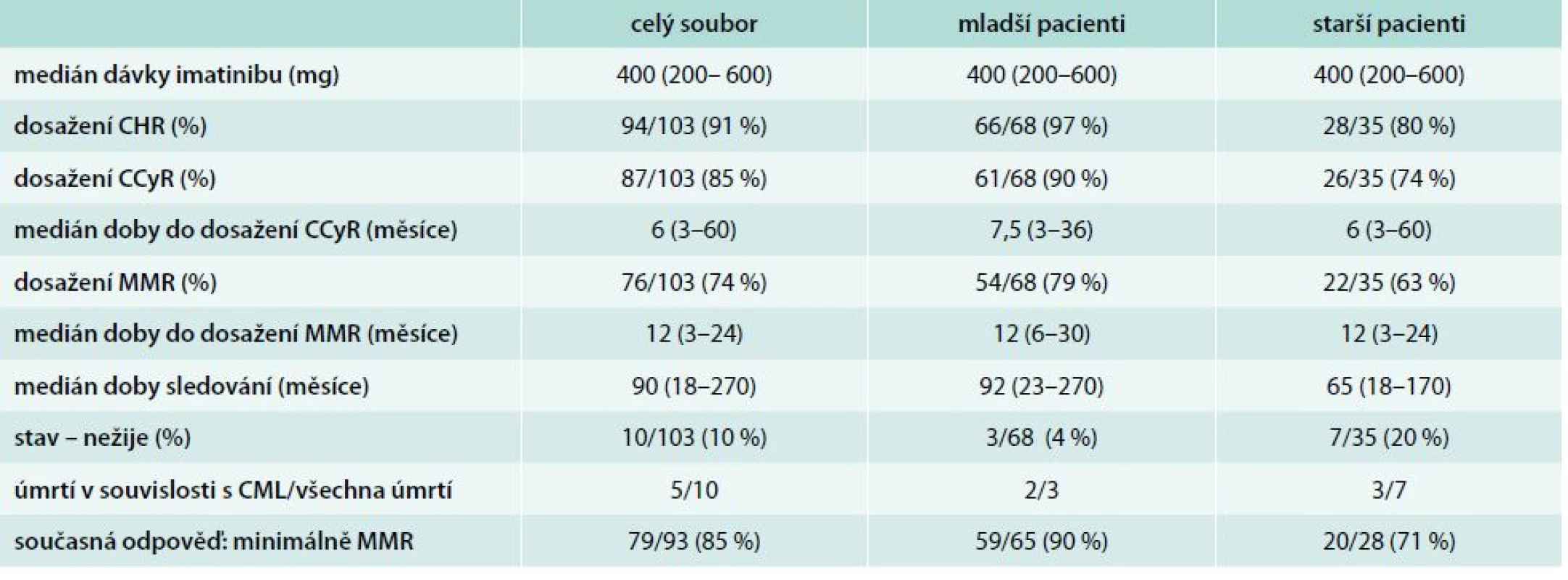
Při léčbě imatinibem se můžeme setkat s toxicitou preparátu, která si vynutí změnu léčby nebo může dojít ke ztrátě optimální léčebné odpovědi imatinibu (rozvoj sekundární rezistence) a je opět nutná změna léčebné strategie. Z tohoto důvodu ve skupině starších pacientů bylo 12 pacientů léčeno TKI 2. generace (7krát dasatinib, 5krát nilotinib), z důvodu rezistence na imatinib 8 pacientů, z důvodu toxicity imatinibu 4 pacienti. Ve skupině mladších pacientů bylo nutné užití 2. linie léčby u 18 pacientů (11krát dasatinib, 7krát nilotinib). Příčinou léčebné změny byl ve 12 případech rozvoj rezistence na imatinib a v 6 případech léčebná toxicita imatinibu. Rozdíly v rozvoji rezistence v našich analyzovaných skupinách nejsou závislé na věku pacienta v době diagnózy CML (p = 0,6016). U 4 mladších pacientů bylo nutné použití i 3. linie léčby (2krát dasatinib, 2krát nilotinib).
Medián doby sledování celého souboru je 90 měsíců (rozpětí 18–270 měsíců), medián sledování ve skupině starších je 65 měsíců (18–170 měsíců) a ve skupině mladších 92 měsíců (23–270 měsíců). Ve skupině starších nemocných zemřelo 7 pacientů (20 %), z toho ve 3 ze 7 případů se jednalo o souvislost s CML ve smyslu progrese choroby. Ve skupině mladších pacientů jsme zaznamenali úmrtí pouze ve 3 případech (4 %), z toho ve 2/3 případů se jednalo o souvislost s CML ve smyslu progrese choroby do blastického zvratu. Příčinou úmrtí pacientů bez souvislosti s CML bylo ve skupině starších 2krát kardiální selhání, 1krát karcinom prsu, 1krát infekce, ve skupině mladších pacientů se v 1 případě jednalo o důsledky chronického renálního selhání u polymorbidního nemocného.
Při hodnocení pravděpodobnosti přežití v 10 letech vidíme, že v případě CML jako příčiny úmrtí se pohybuje kolem 84 % u starších pacientů a 98 % u mladších pacientů (graf 2) a rozdíl mezi skupinami je na hranici statistické významnosti (p = 0,0452). Toto hodnocení je významně ovlivněno skutečností, že do analýzy nebyli zahrnuti mladší rizikoví nemocní, kteří již primárně pro pokročilou fázi choroby nebo primární rezistenci na imatinib byli směřováni k alogenní transplantaci krvetvornými buňkami. Při hodnocení všech příčin úmrtí pacientů v souboru jsme zjistili, že pravděpodobnost přežití u mladších pacientů v 10 letech bude 98 % vs 64 % u starších pacientů (graf 3). Zde je přítomen významný statistický rozdíl (p = 0,0003), protože s rostoucím věkem přirozeně narůstá výskyt přidružených chorob, které jsou častěji příčinou úmrtí než hematologické onemocnění.
Graf 2. Celkové přežití pacientů při mortalitě z jakékoliv příčiny 
Graf 3. Celkové přežití pacientů při mortalitě z důvodu CML 
Podíváme-li se na současnou léčebnou odpověď pacientů, můžeme konstatovat, že ve skupině mladších pacientů má minimálně MMR 59 ze 65 (90 %) pacientů a ve skupině starších nemocných je MMR přítomna u 20 z 28 (71 %) pacientů.
Diskuze
Tradičně byl vyšší věk pacientů s CML v době diagnózy považován za negativní prognostický faktor a věk pacienta je dosud nedílnou součástí prognostických skórovacích indexů (Sokalův a Hasfordův index) [6,7]. V nové éře TKI se však zdá, že věk pacienta ztrácí svůj silný prognostický význam. První potvrzení této skutečnosti přinesla práce Cortese z roku 2003, ve které dosáhlo CCyR 79 % starších nemocných (≥ 60 let) a 86 % mladších nemocných (< 60 let) [10]. Tyto výsledky jsou velmi podobné výsledkům naší analýzy (CCyR 74 % vs 90 %) včetně shodného věkového rozdělení. V největším souboru publikovaném v roce 2011 Gugliottou ve 12 měsících léčby dosáhlo CCyR 78 % starších a 77 % mladších nemocných [11]. Dosažení MMR v 18 měsících léčby v této práci bylo 57 % ve skupině starších a 63 % ve skupině mladších pacientů bez statistického rozdílu ve skupinách. Tyto výsledky jsou ve shodě i s naším hodnocením, neboť jsme rovněž neprokázali statistický rozdíl v dosažení MMR po 18 měsících léčby (63 % starších pacientů vs 79 % mladších pacientů). Jedinou prací, která zaznamenala statistický rozdíl v dosažení CCyR v závislosti na věku, je starší práce Rostiho z roku 2007 [12]. V této práci CCyR dosáhlo ve 12 měsících léčby pouze 36 % starších nemocných vs 58 % mladších nemocných. Přehledné výsledky jednotlivých analýz s počty hodnocených pacientů, věkovým složením, dosaženými odpověďmi a závěry shrnuje tab. 4 [10–16].
Tab. 4. Léčebný efekt imatinibu ve studiích u pacientů s CML 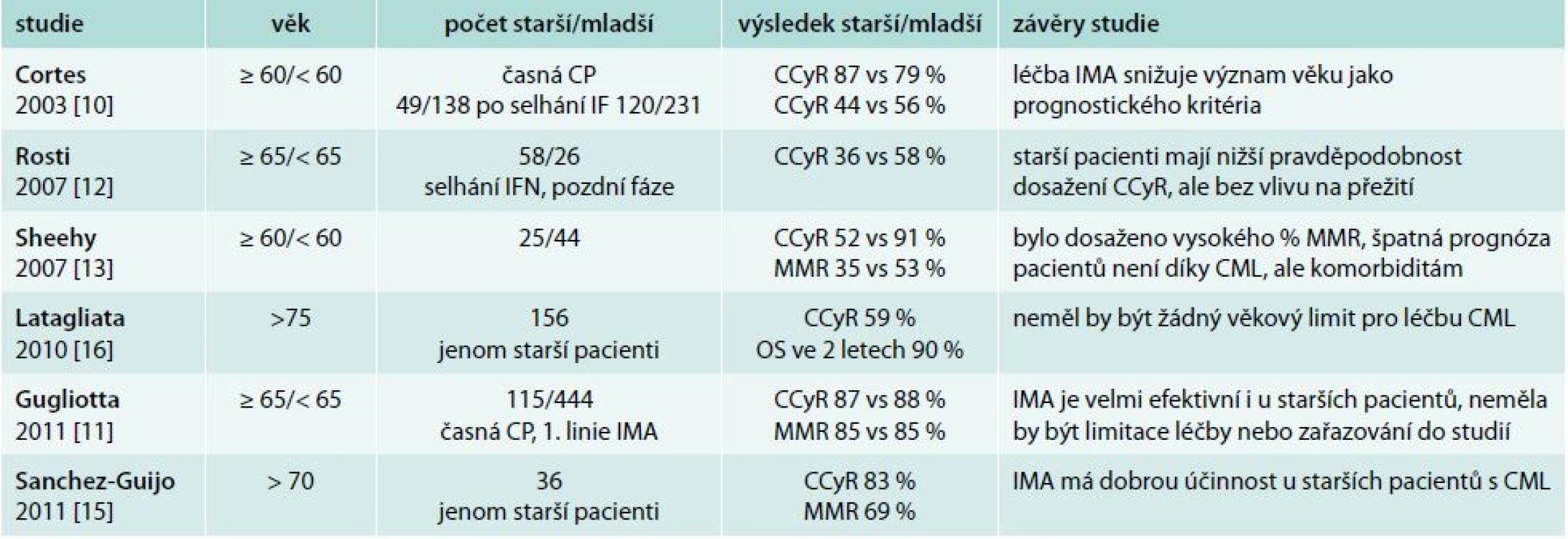
V našem souboru jsme prokázali, že není přítomen rozdíl ve skupinách v rozvoji rezistence na léčbu a tento závěr byl potvrzen i v práci Gugliotty. Ostatní práce tuto problematiku nehodnotily. Úmrtí v souvislosti s CML se v našem souboru objevilo u 3 % mladších a u 8 % starších pacientů, což jsou srovnatelné výsledky s prací Gugliotty (3,6 % u mladších a 5,2 % u starších pacientů). Ve shodě s touto prací jsme prokázali významný statistický rozdíl (p = 0,0003) ve skupinách při hodnocení úmrtí nesouvisejícího s CML. V našem souboru zemřelo z jiné příčiny než CML 11,5 % starších a 1,5 % mladších nemocných. V souboru hodnoceném Gugliottou to bylo 15 % starších a 3 % mladších pacientů.
Pouze v některých analýzách je hodnocena toxicita léčby imatinibem. Zpravidla se u starších pacientů objevuje vyšší výskyt hematologické toxicity a naproti tomu nebývá větší rozdíl ve výskytu toxicity nehematologické. Naše hodnocení prokázalo hematologickou toxicitu stupně III. + IV. u 9 % starších a 3 % mladších pacientů, což je nižší výskyt toxicity v porovnání s výsledky Rostiho a Latagliaty (12 % a 25 % u starších pacientů a 6 % a 9 % u mladších pacientů) [12,16]. Tento nižší výskyt hematologické toxicity v našem souboru může být ovlivněn ale jiným věkovým rozdělením (≥ 60 vs ≥ 65 let).
Dosud bylo publikováno málo prací, které porovnávaly léčebnou odpověď TKI 2. generace (dasatinib, nilotinib) s ohledem na věk pacientů. Ale i z těchto 3 publikovaných souborů vyplývá, že výsledky léčby u mladších i starších pacientů jsou srovnatelné a není věková limitace při nutnosti zahájení této léčby [17–20].
Závěr
Naše analýza potvrdila, že léčba CML starších pacientů přináší srovnatelné léčebné odpovědi jako u mladších pacientů (CCyR 74 % vs 90 % ve 12. měsíci léčby a MMR 63 % a 79 % v 18. měsíci léčby). Rozdíly při dosažení optimálních odpovědí ve skupinách jsou statisticky významné pouze ve 3. měsíci při hodnocení CHR (p = 0, 0068). Rozdíly v pravděpodobnosti přežití v 10 letech u starších a mladších pacientů v závislosti na CML jsou na hranici statistické významnosti (p = 0,0452), ale je však přítomen významný statistický rozdíl v pravděpodobnosti přežití obou skupin při hodnocení všech příčin úmrtí (p = 0,0003). V našem souboru jsme u starších pacientů zaznamenali vyšší výskyt hematologické toxicity, což může souviset s určitou horší schopností reparace krvetvorby, bohatší medikací a komorbiditami pacientů. Naše analýza potvrdila, že léčba imatinibem přináší výrazný benefit i pro starší pacienty a u všech pacientů bez rozdílu věku by mělo být její zahájení zvažováno.
Doručeno do redakce 20. 4. 2015
Přijato po recenzi 25. 5. 2015
MUDr. Petra Bělohlávková
belohlavkova@fnhk.cz
IV. interní hematologická klinika LF UK a FN Hradec Králové
www.fnhk.cz
Zdroje
1. Faber E, Indrák K et al. Chronická myeloidní leukémie. Galén: Praha 2010. ISBN 978–80–7262–680–9.
2. Rohrbacher M, Berger U, Hochhaus A et al. Clinical trials underestimate the age of chronic myeloid leukemia (CML) patients. Incidence and median age of Ph/BCR-ABL - positive CML and other chronic myeloproliferative disorders in a representative area in Germany. Leukemia 2009; 23(3): 602–604.
3. Seiter K. Considerations in the Management of Elderly Patients With Chronic Myeloid Leukemia. Clin Lymph Myeloma Leukemia 2012; 12(1): 12–19.
4. Indrák K, Faber E, Jarošová M. Léčba chronické myeloidní leukemie (CML) v éře imatinibu. Vnitř Lék 2009; 55(Suppl 1): S65-S73.
5. Klamová H. Inhibitory tyrozinových kináz – zásadní změna v prognóze chronické myeloidní leukemie. Vnitř Lék 2013; 59(7): 624–626.
6. Sokal JE, Cox EB, Baccarani M et al. Prognostic discrimination in “good-risk” chronic granulocytic leukemia. Blood 1984; 63(4): 789–799.
7. Hasford J, Pfirrmann M, Hehlmann R et al. A new prognostic score for survival of patients with chronic myeloid leukemia treated with interferon alfa. Writing Committee for the Collaborative CML Prognostic Factors Project Group. J Natl Cancer Inst 1998; 90(11): 850–858.
8. Baccarani M, Cortes J, Pane F European Leukemia Net. Chronic myeloid leukemia: an update of concepts and management recommendations of European Leukemia Net. J Clin Oncol 2009; 27(35): 6041–6051.
9. Baccarani M, Deininger MW, Rosti G et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood 2013; 122(6): 872–884.
10. Cortes J, Talpaz M, O’Brien S et al. Effects of age on prognosis with imatinib mesylate therapy for patients with Philadelphia chromosome-positive chronic myelogenous leukemia. Cancer 2003; 98(6): 1105–1113.
11. Gugliotta G, Castagnetti F, Palandri F et al. Frontline imatinib treatment of chronic myeloid leukemia: no impact of age on outcome, a survey by the GIMEMA CML Working Party. Blood 2011; 117(21): 5591–5599.
12. Rosti G, Iacobucci I, Bassi S et al. Impact of age on the outcome of patients with chronic myeloid leukemia in late chronic phase: results of a phase II study of the GIMEMA CML Working Party. Haematologica 2007; 92(1): 101–105.
13. Sheehy OM, Irvine AE, Cuthbert RJ et al. Use of imatinib mesylate in elderly patients in Northern Ireland: evidence of comparable haematological and molecular responses to younger patients. Hematology 2008; 13(3): 133–136.
14. Latagliata R, Ferrero D, Cavazzini F et al. Imatinib in very elderly patients with chronic myeloid leukemia in chronic phase: a retrospective study. Drugs Aging 2013; 30(8): 629–637.
15. Sanchez-Guijo FM, Duran S, Galende J et al. Evaluation of tolerability and efficacy of imatinib mesylate in elderly patients with chronic phase CML: ELDERGLI study. Leuk Res 2011; 35(9): 1184–1187.
16. Latagliata R, Breccia M, Carmosino I et al. “Real-life” results of front-line treatment with Imatinib in older patients (≥ 65 years) with newly diagnosed chronic myelogenous leukemia. Leuk Res 2010; 34(11): 1472–1475.
17. Latagliata R, Breccia M, Castagnetti F et al. Dasatinib is safe and effective in unselected chronic myeloid leukaemia elderly patients resistant/intolerant to imatinib. Leuk Res 2011; 35(9): 1164–1169.
18. Lipton JH, le Coutre PD, Wang J et al. Nilotinib in elderly chronic myeloid leukemia patients in chronic phase (CML-CP) with imatinib resistance or intolerance: efficacy and safety analysis. Blood (ASH Annual Meeting Abstracts) 2008; 112 : 3233.
19. le Coutre PD, Turkina A, Kim DW et al. Efficacy and safety of nilotinib in elderly patients with imatinib-resistant or -intolerant chronic myeloid leukemia (CML) in chronic phase (CP): a sub-analysis of the ENACT (Expanding Nilotinib Access in Clinical Trials) study. Blood (ASH Annual Meeting Abstracts) 2009; 114(22): 3286.
20. Breccia M, Luciano L, Latagliata R et al. Age influences initial dose and compliance to imatinib in chronic myeloid leukemia elderly patients but concomitant comorbidities appear to influence overall and event-free survival. Leuk Res 2014; 38(10): 1173–1176.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 9- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Radiojod u nízkorizikového karcinomu štítné žlázy – editorial
- Cílená léčba chronické myeloidní leukemie u starších pacientů – editorial
- Tyrozinkinázové inhibitory v léčbě starších pacientů s chronickou myeloidní leukemií – editorial
- Chronická žilní onemocnění – nutnost přesnější diferenciace stavů k určení optimálního způsobu léčby – editorial
- Kavální filtry v roce 2015 – komu, kdy a jak? – editorial
- Stravování a kardiovaskulární onemocnění – dialogy a protimluvy – editorial
- Návrh optimálního léčebného postupu v léčbě nízkorizikového karcinomu štítné žlázy
- Sekundární humorální imunodeficience u nemocných se systémovým lupus erythematodes
- Má věk nemocných s chronickou myeloidní leukemií při léčbě imatinibem vliv na dosaženou léčebnou odpověď?
- Role metabolického syndromu v gastroenterologii
- Účelnost zavádění kaválních filtrů z pohledu internisty
- Terapeutický potenciál mikronizované purifikované flavonoidní frakce (MPFF) diosminu a hesperidinu v rámci léčby chronického žilního onemocnění
- Změny stravovacích návyků ve vztahu k rizikovým faktorům a kardiovaskulární mortalitě
-
Myopatie při Waldenströmově makroglobulinemii.
Popis případu a přehled autoimunitních projevů monoklonálních imunoglobulinů typu IgM - František Kopřiva. Chronický kašel. Průvodce ošetřujícího lékaře
- Jan Máca et al. ARDS v klinické praxi
- Rudolf Kotas. Bolesti hlavy v klinické praxi
- Josef Veselka, Vilém Rohn a kolektiv. Kardiovaskulární medicína
- (Ne)očekávané výsledky studie EMPA-REG OUTCOME™
- Poznámka k diferenciální diagnostice hyponatremie
- Acute Leukemias XV, Biology and Treatment Strategies
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Terapeutický potenciál mikronizované purifikované flavonoidní frakce (MPFF) diosminu a hesperidinu v rámci léčby chronického žilního onemocnění
- Účelnost zavádění kaválních filtrů z pohledu internisty
- Návrh optimálního léčebného postupu v léčbě nízkorizikového karcinomu štítné žlázy
- Poznámka k diferenciální diagnostice hyponatremie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



