-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Antitrombotická léčba a nevarikózní krvácení do horní části gastrointestinálního traktu
Antithrombotic therapy and nonvariceal upper gastrointestinal bleeding
Background:
The incidence of acute upper gastrointestinal bleeding is about 85–108/100,000 inhabitants per year, nonvariceal bleeding accounts for 80–90 %. Antiplatelet and anticoagulation treatment are the significant risk factors for upper gastrointestinal bleeding.Objectives:
To evaluate the occurrence of upper gastrointestinal bleeding in the general community of patients in a county hospital. And to compare the role played by antiplatelet and anticoagulation drugs and other risk medication.Design and methods:
Retrospective analysis of patients over 18 years of age who underwent endoscopy for acute upper gastrointestinal bleeding or anaemia (haemoglobin < 100 g/l) with proved source of blood losses in upper gastrointestinal tract during a hospital stay in 2013 (from January to June).Results:
We included 111 patients of average age 69 ± 15 years, men 60 %. Nonvariceal bleeding accounted for 90 % of the cases. None of the patients with variceal bleeding (10 % of patients) took antiplatelet or anticoagulation therapy. There were 100 patients with nonvariceal bleeding of average age 70 ± 15, 61 % men. With the symptoms of acute bleeding (hematemesis, melena) presented in 73 % of patients. The most frequent cause of bleeding was gastric and duodenal ulcer (54 %). 32 % of patients with nonvariceal bleeding had antiplatelets, 19 % anticoagulants and 10 % used nonsteroidal anti-inflammatory drugs, selective serotonin reuptake inhibitors or corticosteroids. 30-days mortality of patients with nonvariceal bleeding was 11 %, annual mortality was 23 %. There was no significant difference in mortality, blood transfusion requirements or surgical intervention between the patients with antithrombotic agents and without them. 25 % of patients (8 patients) using acetylsalicylic acid did not fulfil the indication for this treatment.Conclusion:
Among the patients examined by endoscopy for symptomatic nonvariceal bleeding and/or anaemia (haemoglobin < 100 g/l) significantly higher portions of patients are taking antiplatelet rather than anticoagulation therapy. This may be caused by greater use of these drugs in the population, but on the other hand it may reflect an association with greater risk of gastrointestinal bleeding. With regard to that, it is alarming, that there still exists a nonnegligible percentage of patients taking acetylsalicylic acid even though they do not meet the indication for the prescription according to the guidelines.Key words:
antiplatelet therapy and anticoagulation – upper gastrointestinal bleeding
Autoři: Veronika Belanová 1; Martin Gřiva 2
Působiště autorů: Oddělení intenzivní péče operačních oborů Krajské nemocnice T. Bati, a. s., Zlín, vedoucí pracoviště prim. MUDr. Anna Šobáňová 1; Kardiocentrum pro dospělé Interní kliniky Krajské nemocnice T. Bati, a. s., Zlín, vedoucí pracoviště prim. MUDr. Jiří Latta 2
Vyšlo v časopise: Vnitř Lék 2015; 61(12): 1016-1022
Kategorie: Původní práce
Souhrn
Úvod:
Incidence akutního krvácení do horní části gastrointestinálního traktu (GIT) se udává 85–108/100 000 obyvatel za rok, přičemž nonvariceální krvácení odpovídá za 80–90 %. Antiagregační a antikoagulační terapie patří mezi významné rizikové faktory pro krvácení do horní části GIT.Cíl práce:
Zjistit výskyt krvácení do horní části GIT u běžné populace pacientů v podmínkách krajské nemocnice, srovnání podílu antiagregancií, antikoagulancií a dalších rizikových léků na dané problematice.Soubor a metodika:
Retrospektivní analýza pacientů, kteří v roce 2013 (leden–červen) podstoupili za hospitalizace gastroskopii pro akutní krvácení do horní části GIT nebo pro anémii (Hb < 100 g/l) s verifikovaným zdrojem ztrát v horní části GIT.Výsledky:
Soubor tvořilo 111 pacientů s průměrným věkem 69 ± 15 let, mužů bylo 60 %. Nonvariceální krvácení tvořilo 90 %. Žádný z pacientů s variceálním krvácením (10 % pacientů) neužíval antiagregační či antikoagulační terapii. Pacientů s nonvariceálním krvácením do horní části GIT bylo 100 s průměrným věkem 70 ± 15 let, 61 % mužů. Příznaky akutního krvácení (hemateméza, meléna) mělo 73 % těchto pacientů. Nejčastější příčinou krvácení byla vředová choroba gastroduodena, a to v 54 % případů. Ze všech pacientů s nonvariceálním krvácením do GIT užívalo antiagregancia 32 %, antikoagulancia 19 %, dalších 10 % pacientů užívalo nesteroidní antirevmatika, selektivní inhibitory zpětného vychytávání serotoninu nebo kortikoidy. 30denní mortalita pacientů s nonvariceálním krvácením byla 11 % a roční mortalita 23 %. Nebyl zjištěn významný rozdíl v mortalitě, nutnosti aplikace krevních transfuzí nebo chirurgické intervence u pacientů na antitrombotické terapii a bez ní. 25 % (8 pacientů) s terapií kyselinou acetylsalicylovou (ASA) nebylo k této léčbě indikováno dle guidelines.Závěr:
V souboru pacientů ošetřených gastroskopií pro symptomatické nonvariceální krvácení do GIT nebo anémií (Hb < 100 g/l) je signifikantně větší podíl léčených antiagregancii než antikoagulancii. To může reflektovat větší zastoupení této léčby v populaci, ale také její vyšší riziko pro vznik GIT krvácení. V souvislosti s tím vyznívá varovně fakt, že stále existuje nezanedbatelné procento pacientů, kteří užívají kyselinu acetylsalicylovou i přesto, že nesplňují indikaci k této terapii.Klíčová slova:
antiagregační léčba – antikoagulační léčba – krvácení do gastrointestinálního traktuÚvod
Incidence akutního krvácení do horní části gastrointestinálního traktu (GIT), definováno jako krvácení nad Treitzovou řasou, se v poslední dekádě pohybuje v Evropě v rozmezí 85–108/100 000 obyvatel za rok [1–4]. 30denní mortalita se pohybuje mezi 8–13 % [5–8]. Nonvariceální krvácení odpovídá přibližně za 80–90 % krvácení do horního GIT [9,10]. Zlepšením diagnostiky a léčby kardiovaskulárních nemocí dochází k nárůstu počtu pacientů na antiagregační nebo antikoagulační léčbě [4]. Obojí je významným rizikovým faktorem pro krvácení do horní části GIT [11–13].
Cíl práce
Zjistit výskyt krvácení do horní části GIT v recentní minulosti u běžné populace pacientů v podmínkách krajské nemocnice, srovnání podílu antiagregancií, antikoagulancií a další rizikové léčby na dané problematice.
Soubor a metodika
Retrospektivní analýza pacientů, kteří v roce 2013 (leden–červen) podstoupili za hospitalizace gastroskopii pro akutní symptomatické krvácení do horní části GIT (hemateméza, meléna) nebo pro středně těžkou a těžkou anémii (Hb < 100 g/l v době gastroskopie) se zdrojem ztrát v horní části GIT. Vyloučeni byli pacienti, kteří měli anémii z důvodu jiné vysvětlitelné příčiny, bez nálezu významné patologie v horní části GIT. Pokud byl pacient rehospitalizován v tomto období pro krvácení do horní části GIT, v úvahu se brala jen první hospitalizace.
Kvalitativní proměnné byly porovnány pomocí χ2 testu o nezávislosti dvou proměnných. Pokud nebylo možné aplikovat χ2 test o nezávislosti dvou proměnných, byla použita Monte Carlo simulace s počtem simulací 5 000. Spojité proměnné byly vyjádřeny jako průměr se standardní odchylkou. Kategorické proměnné byly charakterizovány četností a procentuálně. Hladina významnosti byla nastavena na hodnotu p < 0,05.
Výsledky
Soubor tvořilo 111 pacientů průměrného věku 69 ± 15 let, mužů bylo 60 %. Nonvariceální krvácení tvořilo 90 % probandů. Ve sledovaném období 6 měsíců bylo opakovaně hospitalizováno pro akutní krvácení do horního GIT 7 pacientů (6 %).
Žádný z pacientů s variceálním krvácením (10 % pacientů z našeho souboru) neužíval antiagregační či antikoagulační terapii. Roční mortalita těchto pacientů byla 45 % (30denní 9 %).
Pacientů s nonvariceálním krvácením bylo 100. Jejich charakteristiku uvádí tab. 1. Příznaky akutního krvácení (hemateméza, meléna) mělo 73 %. 30denní mortalita ze všech příčin byla v této podskupině 11 %, roční mortalita pak 23 %. Ze všech pacientů s nonvariceálním krvácením do GIT užívalo antiagregační terapii 32 %, antikoagulační terapii 19 %, dalších 10 % pacientů užívalo nesteroidní antirevmatika (NSA), selektivní inhibitory zpětného vychytávání serotoninu (SSRI) nebo kortikoidy. Kombinaci antiagregace a antikoagulace měl v medikaci jen jediný pacient, rovněž jen jeden pacient užíval jako antikoagulační terapii nové perorální antikoagulancium. Indikace k antiagregační a antikoagulační terapii uvádí tab. 2 a tab. 3. Nebyl zjištěn signifikantní rozdíl v podání transfuzí, nutnosti chirurgické intervence a mortalitě u pacientů užívajících antitrombotickou terapii a bez ní (tab. 4).
Tab. 1. Charakteristika pacientů s nevariceálním krvácením 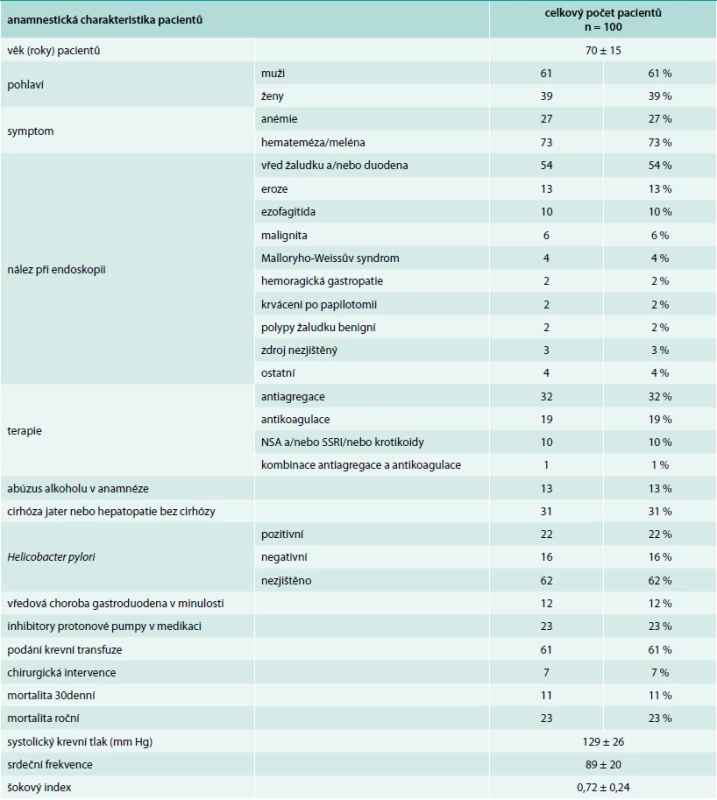
NSA – nesteroidní antirevmatika, SSRI – selektivní inhibitory zpětného vychytávaní serotoninu Tab. 2. Indikace k antiagregační terapii 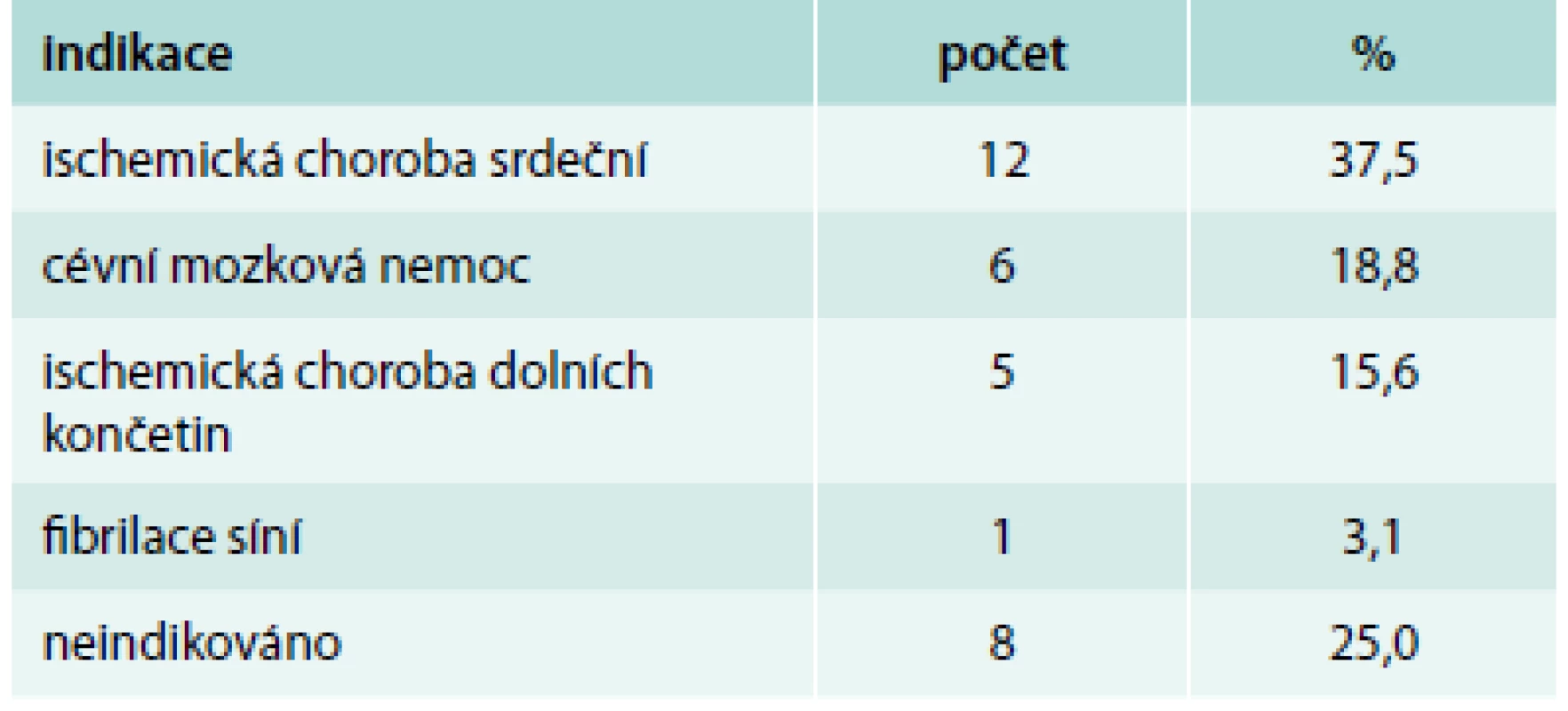
Tab. 3. Indikace k antikoagulační terapii 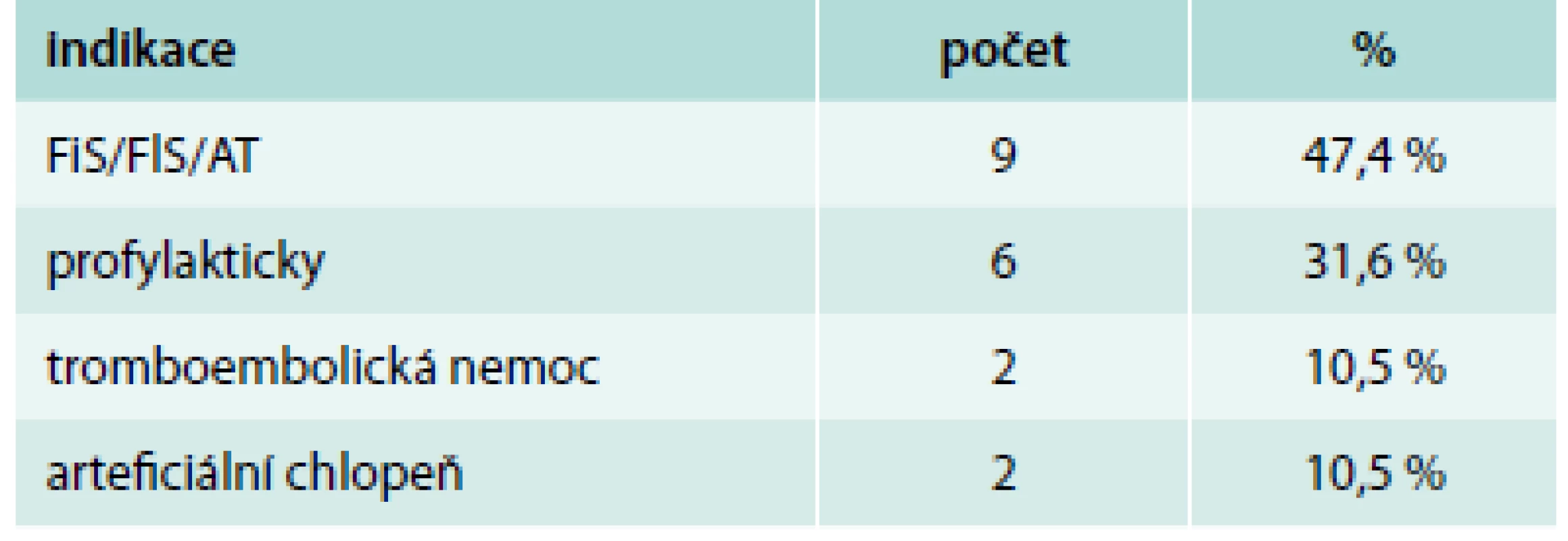
FiS – fibrilace síní, FlS – flutter síní, AT – síňová tachykardie Tab. 4. Porovnání skupiny pacientů s antikoagulací, antiagregací, jinou rizikovou medikací a bez rizikové terapie 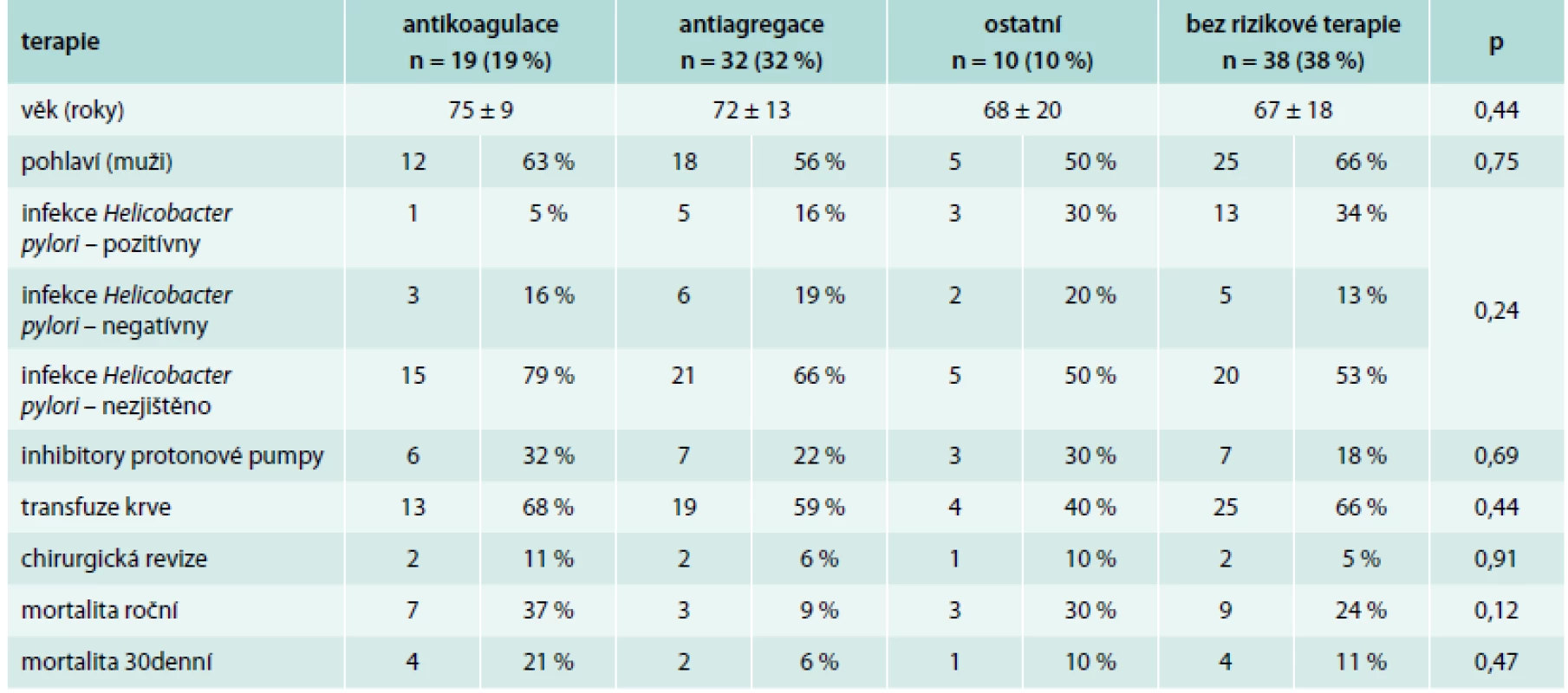
Diskuse
Antiagregační a antikoagulační terapie je především v současné kardiologii využívána v mnoha indikacích. K dosažení nižší aktivity krevních destiček nebo koagulačních faktorů se nabízí poměrně velké množství účinných látek a jejich kombinací. Není pochyb, že antiagregancia a antikoagulancia jsou rizikovými léky pro krvácení do horní části GIT [11–13] a v poslední době jejich používání stoupá [4,9]. Také další lékové skupiny jako SSRI, NSA a kortikosteroidy zvyšují riziko krvácení do horní části GIT [13–17] a jejich spotřeba průběžně narůstá [10,18]. Ne všichni kardiologové jsou informováni o proběhlých krvácivých komplikacích svých pacientů. Prezentovaná práce vychází z každodenního dialogu kardiologického a gastroenterologického týmu v rámci interního oddělení krajské nemocnice, především při zvažování profitu a rizika léčby u některých hraničních indikací nebo polymorbidních rizikových pacientů. Ačkoliv jsou k dispozici některé nástroje stratifikující riziko krvácivých komplikací (především u antikoagulační léčby) [19–22], finálně je rozhodnutí o léčbě na konkrétním lékaři nebo konsenzu týmu.
Cílem práce byla retrospektivní analýza medikace pacientů s klinicky významným krvácením do horní části gastrointestinálního traktu projevujícím se buď akutními symptomy, nebo středně těžkou až těžkou poztrátovou anémií. Byly sledovány souvislosti mezi typem krvácení, gastroskopickým nálezem a medikací zvyšující výskyt hemoragických komplikací.
Není překvapením, že hlavní příčinou nonvariceálního krvácení je v naší práci i ve světové literatuře krvácející peptický vřed [2,4,6,9,10,14,23–25]. V posledních letech došlo u české populace k poklesu prevalence infekce Helicobacter pylori z 41,7 % na 23,5–30,4 % [26–28]. V našem souboru byla infekce Helicobacter pylori přítomna u 22 % pacientů, v 16 % byla negativní a v 62 % případů nebyla stanovována, vzhledem k různorodosti etiologie krvácení do horního GIT.
U pacientů s nonvariceálním krvácením 38 % neužívalo žádný z léků zvyšujících riziko krvácení, ostatní byli léčeni některou z rizikových lékových skupin. Téměř polovina pacientů (48 %) na antitrombotické terapii užívala tuto medikaci déle než rok, což je dáno z velké části tím, že v sekundární prevenci kardiovaskulárních a cerebrovaskulárních onemocnění je indikována antiagregace trvale. Na druhé straně, v některých případech trvá obava lékařů z vysazení antikoagulační terapie i u pacientů, u nichž dále není tato terapie indikována (provokovaná trombóza). U 12 % pacientů nebylo možné z dostupné dokumentace zjistit dobu užívání antitrombotik (tab. 5).
Tab. 5. Délka užívání antitrombotické terapie 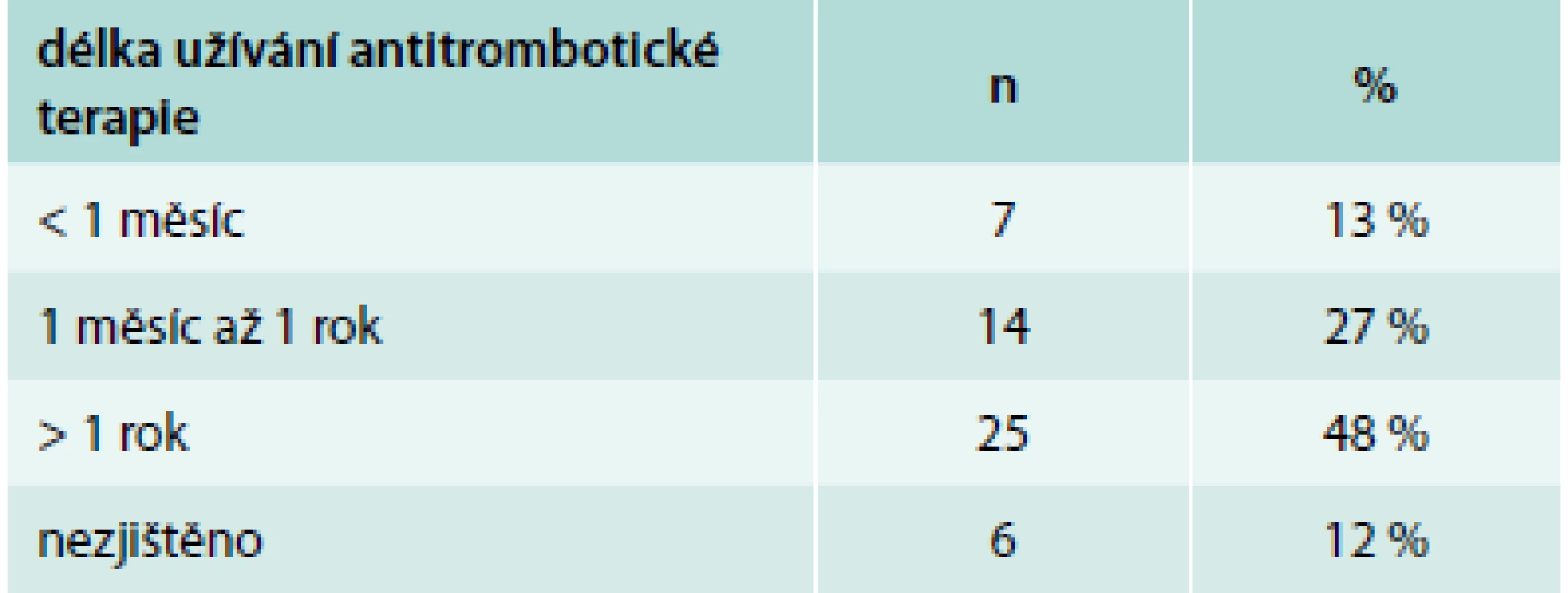
Podrobnou analýzu léků zvyšujících riziko krvácení do GIT v celém rozsahu provedli Delaney et al [12]. Z jejich zjištění vyplývá, že kyselina acetylsalicylová (ASA) v monoterapii by měla mít nízké riziko indukce krvácení ve srovnání s ostatními antitrombotiky (graf 1). Přesto je prokázáno, že u pacientů s antiagregační léčbou je vyšší výskyt peptických vředů než u pacientů bez ní [24]. V našem souboru krvácení do GIT u podskupiny léčené některým z antitrombotických léků největší procento tvořila ASA v monoterapii (60 %), jeden pacient užíval duální antiagregační léčbu. Pokud vyselektujeme podskupinu s krvácejícím gastroduodenálním vředem, je procento pacientů léčených ASA ještě vyšší (68 % pacientů na antitrombotické terapii), tab. 6.
Tab. 6. Terapie u pacientů s gastroduodenálním vředem 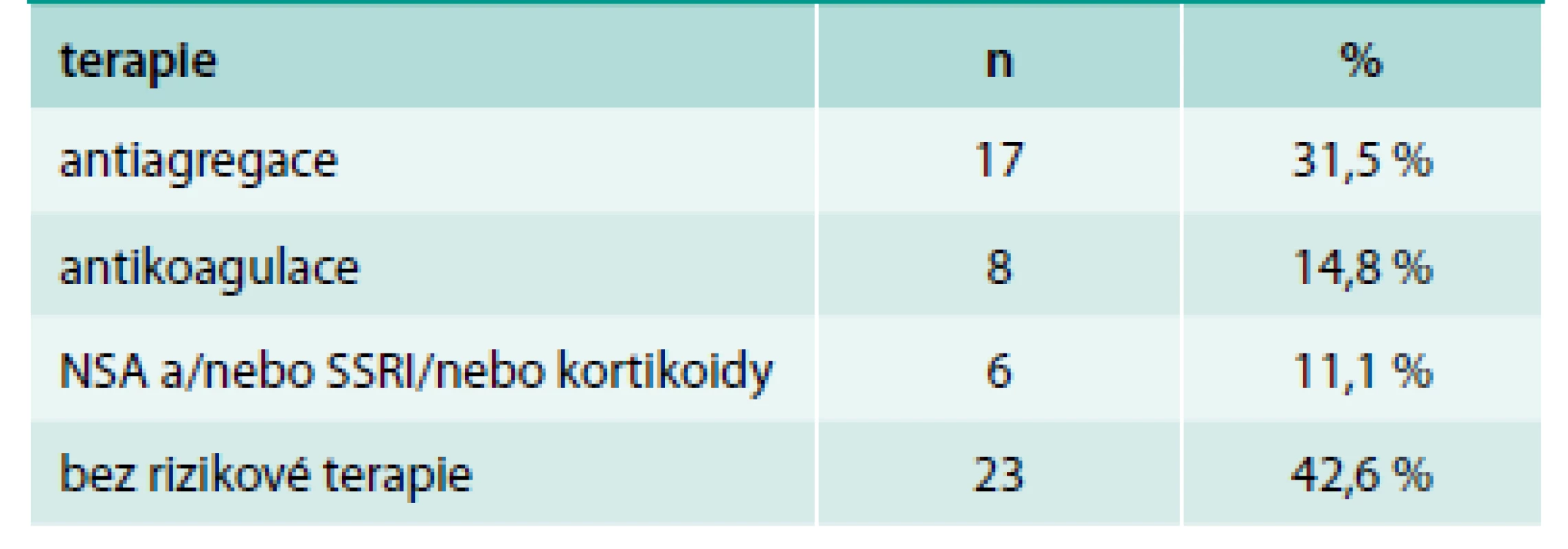
NSA – nesteroidní antirevmatika, SSRI – selektivní inhibitory zpětného vychytávání serotoninu Graf 1. Kyselina acetylsalicylová (ASA) v monoterapii má nízké riziko indukce krvácení ve srovnání s ostatními antitrombotiky 
Z retrospektivní analýzy nelze posoudit, odráží-li tento výsledek větší zastoupení užívání ASA v populaci ve srovnání s ostatními antitrombotiky, nebo zda je potenciál k indukci peptického vředu v našich podmínkách vyšší než u warfarinu. Varovně však v této souvislosti vyznívá zjištění, že 25 % (8 pacientů) léčených ASA nemělo k této medikaci žádnou indikaci opírající se o některý z oficiálních doporučených postupů! Bohužel i v zahraničí byl publikován podobně alarmující údaj [29]. Dle guidelines Evropské kardiologické společnosti je kyselina acetylsalicylová indikována u všech pacientů v sekundární prevenci kardiovaskulárních onemocnění, u fibrilace síní je doporučována jen u pacientů, kteří odmítají nebo netolerují (z důvodů, které nesouvisejí s krvácením) perorální antikoagulancia. V primární prevenci není antiagregační terapie doporučena kvůli zvýšenému riziku krvácení [30,31]. Dle jiných doporučení by měla být antiagregační terapie zvážena u pacientů s hypertenzí a redukovanou funkcí ledvin nebo s vysokým kardiovaskulárním rizikem [32]. Antiagregace je také indikována u některých hematologických nemocí [33]. Celkově v našem souboru bylo 8 pacientů na antiagregační terapii, bez anamnézy onemocnění, u kterého by byla tato terapie indikována. U všech těchto pacientů byla ASA po epizodě krvácení do horního GIT z chronické medikace vysazena. V některých případech, snad k nasazení terapie ASA vede lékaře vyšší věk pacienta, ačkoliv průměrný věk se v tomto případě nelišil od průměrného věku pacientů s nonvariceálním krvácením.
Warfarin užívalo téměř o polovinu méně krvácejících pacientů. Kombinovanou léčbu (warfarin + klopidogrel) užíval pouze jeden krvácející pacient. Redukce trvání „triple“ terapie na jeden měsíc je jistě optimální postup. U duální léčby jsou pacienti pravděpodobně lépe sledováni a při vyšším riziku krvácení je doba podávání jednoho z léčiv opět zkracována na nejnutnější minimum. Pouze jeden z ošetřených pacientů užíval nové perorální antikoagulans (dabigatran). V době sledování však byla penetrace populace tímto typem léků velmi nízká.
Nebyl zjištěn rozdíl v užívání inhibitorů protonové pumy (PPI) u pacientů jednotlivých podskupin (tab. 4). Kritéria k profylaktické terapii inhibitory protonové pumpy v prevenci vzniku NSA gastropatie (peptické vředy v žaludku a v duodenu způsobené užíváním ASA nebo nesteroidních antiflogistik) jsou uvedeny v tab. 7 a tab. 8 [34].
Tab. 7. Doporučení pro podávání ASA nebo NSA terapie a IPP 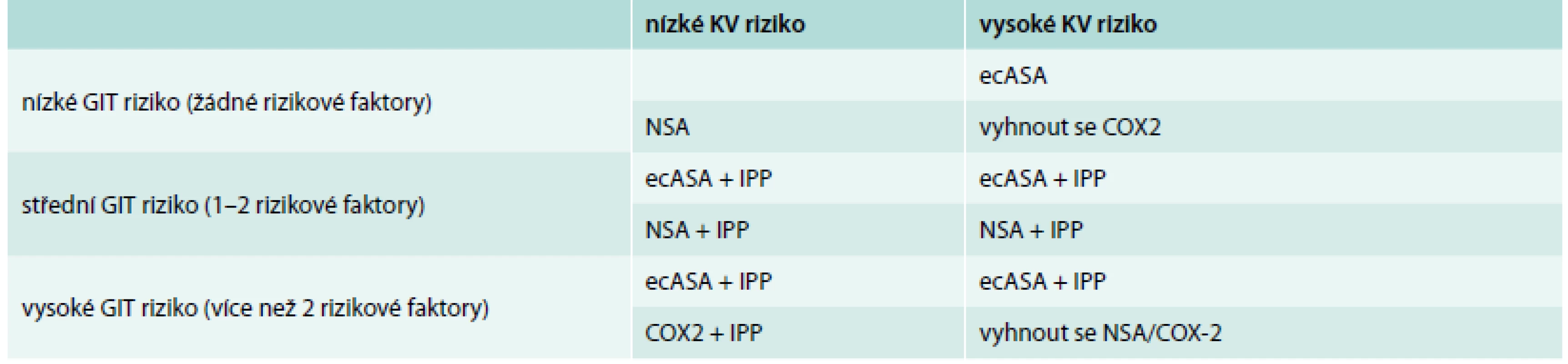
GIT – gastrointestinální, KV – kardiovaskulární, IPP – inhibitory protonové pumpy, NSA – nesteroidní antirevmatika, ecASA – enterosolventní forma kyseliny acetylsalicylové, COX-2 – selektivní inhibitor cyklooxygenázy 2 Tab. 8. Rizikové faktory pro vznik NSA gastropatie 
Rovněž nebyl signifikantní rozdíl v přítomnosti infekce Helicobacter pylori u podskupin. Dle doporučení České gastroenterologické společnosti je eradikace Helicobacter pylori indikována u pacientů s vředovou chorobou žaludku a dvanáctníku ve všech stadiích (aktivní, neaktivní, s komplikacemi či bez nich, stavy po operaci pro vředovou chorobu), s MALT lymfomem žaludku, stavů po operaci karcinomu žaludku, u pacientů s refluxní chorobou jícnu, pokud mají současně vředovou chorobu aktuálně nebo v anamnéze, dále u pacientů s chronickou atrofickou gastritidou Helicobacter pylori pozitivní, s jaterní cirhózou po individuálním posouzení pacienta a před zahájením dlouhodobé léčby nesteroidními antiflogistiky, pokud mají vředovou chorobu v anamnéze a ke zvážení je u pacientů s vyšším rizikem (ženy starší 60 let, současná léčba kortikosteroidy nebo warfarinem, kuřáci) [35].
Za pozornost stojí překvapivé zjištění, že pokud už k nonvariceálnímu krvácení do GIT dojde, pak se podskupiny s rizikovou medikací a bez ní neliší v dalším průběhu hospitalizace (konkrétně není rozdíl v nutnosti aplikace krevních transfuzí, chirurgické intervence nebo v mortalitě). Podání krevních transfuzí bylo v našem výzkumu u nonvariceálního krvácení realizováno u 64 % všech pacientů, což odpovídá údajům z jiných pracovišť [2,3,14]. Potřeba chirurgické intervence je naopak dle různých autorů v poměrně širokém rozmezí 1,9–10 % [3,4,6,9,10,14,18,23,36] a souvisí s možnostmi akutního endoskopického ošetření nebo katetrizační selektivní embolizace tepen. V našem souboru bylo chirurgicky řešeno 7 % akutních krvácení.
Pouze u 3 % našich pacientů se gastroskopií nepodařilo odhalit zdroj akutního symptomatického krvácení do GIT, což je ve srovnání s literárními údaji velmi povzbudivý výsledek [6,14].
Limitace práce
Limitací této práce je relativně malá velikost souboru. Do sledování byli zařazeni pouze pacienti, kteří měli krvácení z horního GIT diagnostikováno endoskopicky. Tím uniklo malé procento pacientů s perforovaným vředem manifestující se náhlou příhodou břišní a primárně chirurgickým řešením. Také se uplatňuje selekční bias, jelikož nebyli zařazeni pacienti s málo významnou anémií s koncentrací hemoglobinu > 100 g/l. Nedostatkem při sledování mortality je čerpání informací o úmrtí z nemocničního informačního systému, v němž není uvedeno úmrtí pacientů, kteří zemřeli mimo nemocnici.
Závěr
V podskupině pacientů s nonvariceálním krvácením do GIT nebo anémií (Hb < 100 g/l) v podmínkách krajské nemocnice je signifikantně větší podíl léčených ASA než antikoagulancii. To může reflektovat větší zastoupení této léčby v naší populaci, nebo její vyšší riziko v našich podmínkách. V souvislosti s tím vyznívá varovně zjištění, že 25 % (8 pacientů) užívalo ASA bez jasné indikace k této terapii.
MUDr. Veronika Belanová
belanovav@seznam.cz
Oddělení intenzivní péče operačních oborů Krajské nemocnice T. Bati, a.s., Zlín
www.kntb.cz
Doručeno do redakce 13. 4. 2015
Přijato po recenzi 28. 7. 2015
Zdroje
1. Crooks C, West J, Card T. Upper gastrointestinal haemorrhage and deprivation: a nationwide cohort study of health inequality in hospital admissions. Gut 2012; 61(4): 514–520.
2. Paspatis GA, Konstantinidis K, Chalkiadakis I et al. Changing trends in acute upper gastrointestinal bleeding in Crete, Greece: a population-based study. Eur J Gastroneterol Hepatol 2012; 24(1): 102–103.
3. Loperfido S, Baldo V, Piovesana E at al. Changing trends in acute upper-GI bleeding: a population-based study. Gastrointest endosc 2009; 70(2): 212–224.
4. Theocharis GJ, Thomopoulos KC, Sakellaropoulos G et al. Changing trends in the epidemiology and clinical outcome of acute upper gastrointestinal bleeding in a defined geographical area in Greece. J Clin Gastroenterol 2008; 42(2): 128–133.
5. Palmer K. Acute upper gastrointestinal heamorrhage. Br Med Bull 2007; 83 : 307–324.
6. Van Leerdam ME, Vreeburg EM, Rauws EAJ et al. Acute Upper GI Bleeding: Did Anything Change?, Time Trend Analysis of Incidence and Outcome of Acute Upper GI Bleeding Between 1993/1994 and 2000. Am J Gastroenterol 2003; 98(7): 1494–1499.
7. Esrailian E, Gralenk IM. Nonvariceal Upper Gastrointestinal Bleeding: Epidemiology and Diagnosis. Gastroenterol Clin North Am 2005; 34(4): 589–605.
8. Tariq SH, Mekhijan G. Gastrointestinal Bleeding in Older Adults. Clin Geriatr Med 2007; 23(4): 769–784.
9. Hearnshaw SA, Logan RF, Lowe D et al. Acute upper gastrointestinal bleeding in the UK: patient characteristics, diagnoses and outcomes in the 2007 UK audit. Gut 2011; 60(10): 1327–1335.
10. Di Fiore F, Lecleire S, Merle V et al. Changes in characteristics and outcome of acute upper gastrointestinal haemorrhage: a comparison of epidemiology and prectices between 1996 and 2000 in a multicentre French study. Eur J Gastroenterol Hepatol 2005; 17(6): 641–647.
11. Hallas J, Dall M, Andries A et al. Use of single and combined antithrombotic therapy and risk of serious upper gastrointestinal bleeding: population based case-control study. BMJ 2006; 333(7571): 726.
12. Delaney JA, Opatrny L, Brophy JM et al. Drug-drug interactions between antithrombotic medications and the risk of gastrointestinal bleeding. CMAJ 2007; 177(4): 347–351.
13. Lanas A, García-Rodríguez LA, Arroyo MT et al. Risk of upper gastrointestinal ulcer bleeding associated with selective cyclo-oxygenase-2 inhibitors, traditional non-aspirin non-steroidal anti-inflammatory drugs, aspirin and combinations. Gut 2006; 55(12): 1731–1738.
14. Hreinsson JP, Kalaitzakis E, Gudmundsson S et al. Upper gastrointestinal bleeding: incidence, etiology and outcomes in a population-based setting. Scand J Gastroenterol 2013; 48(4): 439–447.
15. Loke YK, Trivedi AN, Singh S. Meta-analysis: gastrointestinal bleeding due to interaction between selective serotonin uptake inhibitors and non-steroidal anti-inflammatory drugs. Aliment Pharmacol Ther 2008; 27(1): 31–40.
16. Dall M, Schaffalitzky de Muckadell OB, Lassen AT et al. An association between selective serotonin reuptake inhibitor use and serious upper gastrointestinal bleeding. Clin Gastroenterol Hepatol 2009; 7(12): 1314–1321.
17. Åhsberg K, Höglund P, Kim WH et al. Impact of aspirin, NSAIDs, warfarin, corticosteroids and SSRIs on the site and outcome of non-variceal upper and lower gastrointestinal bleeding. Scand J Gastroenterol 2010; 45(12): 1404–1415.
18. Thomopoulos KC, Vagenas KA, Vagianos CE et al. Changes in aetiology and clinical outcome of acute upper gastrointestinal bleeding during the last 15years. Eur J Gastroneterol Hepatol 2004; 16(2): 177–182.
19. Pisters R, Lane DA, Nieuwlaat H et al. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest 2010; 138(5): 1093–1100.
20. Roldán V, Marín F, Fernández H et al. Predictive value of the HAS-BLED and ATRIA bleeding scores for the risk of serious bleeding in a “real-world” population with atrial fibrillation receiving anticoagulant therapy. Chest 2013; 143(1): 179–184.
21. Caldeira D, Costa J, Fernandes RM et al. Performance of the HAS-BLED high bleeding-risk category, compared to ATRIA and HEMORR2HAGES in patients with atrial fibrillation: a systematic review and meta-analysis. J Interv Card Electrophysiol 2014; 40(3): 277–284.
22. Lip GYH, Frison L, Halperin JL et al. Comparative Validation of a Novel Risk Score for Predicting Bleeding Risk in Anticoagulated Patients with Atrial Fibrillation. J Am Coll Cardiol 2011; 57(2): 173–180.
23. Morales-Uribe CH, Sierra-Sierra S, Hernándéz-Hernández AM et al. Upper gastrointestinal bleeding: risk factors for mortality in two urban centers in Latin America. Rev Esp Enferm Dig 2001; 103(1): 20–24.
24. Barkun A, Sabbah S, Enns R et al. The Canadian Registry on Nonvariceal Upper Gastrointestinal Bleeding and Endoscopy (RUGBE): endoscopic hemostasis and proton pump inhinition are associated with improved outcomes in a real-life setting. Am J Gastroenterol 2004; 99(7): 1238–1246.
25. Hnízdil L, Piskač P, Dvořák M et al. Akutní endoskopické řešení krvácení do horní části gastrointestinálního traktu: zkušenosti jednadvaceti let. Prakt Lék 2011; 91(7): 404–408.
26. Bureš J, Kopáčová M, Škodová Fendrichová M et al. Epidemiologie Helicobacter pylori. Vnitř Lék 2011; 57(12): 993–999.
27. Bureš J, Kopáčová M, Koupil I et al. Significant decrease in prevalence of Helicobacter pylori in the Czech Republic. World J Gastroenterol 2012; 18(32): 4412–4418.
28. Kopacova M, Koupil I, Seifert B et al. Blood pressure and stature in Helicobacter pylori positive and negative persons. World J Gastroenterol 2014; 20(19): 5625–5631.
29. Wikman-Jorgensen P, Lopéz-Calleja E, Safont-Gasó P et al. Antiagregation and anticoagulation, relationship with upper gastrointestinal bleeding. Rev Esp Enferm Dig 2011; 103(7): 360–365.
30. Perk J, De Backer G, Gohlke H et al. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Eur Heart J 2012; 33(13): 1635–1701. Erratum in Eur Heart J 2012; 33(17):2126.
31. Camm AJ, Lip GYH, De Caterina R et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J 2012; 33(21): 2719–2747. Erratum in Eur Heart J 2013; 34(10): 790. Eur Heart J 2013; 34(36): 2850–2851.
32. Mancia G, Fagard R, Narkiewicz K et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J 2013; 34(28): 2159–2219.
33. Penka M, Schwarz J, Campr V et al. Shrnutí doporučení České pracovní skupiny pro Ph-negativní myeloproliferativní onemocnění (CZEMP) České hematologické společnosti ČLS JEP pro diagnózu a terapii BCR/ABL-negativních myeloproliferací. Vnitř Lék 2012; 58(2): 163–168.
34. Lukáš M, Špičák J, Keil R. Doporučení České gastroenterologické společnosti pro podávání antiagregační terapie kyselinou acetylsalicylovou. Gastroent Hepatol 2013; 67(2): 90–94.
35. Bureš J, Dítě P, Fixa B et al. Infekce Helicobacter pylori. Doporučený postup České gastroenterologické společnosti ČSL JEP pro dospělé. Gastroent Hepatol 2013; XX–XX (Guidelines): 1–5.Dostupné z WWW: http://www.cgs-cls.cz/wp-content/uploads/2015/04/guidelines-infekce-helicobacter-pylori.pdf.
36. Konečný M, Ehrmann J, Procházka V et al. Naše zkušenosti s novou organizací péče o nemocné s akutním krvácením do horní části trávicího traktu. Vnitř Lék 2005; 51(1): 36–40.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 12- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Fosfátová homeostáza při selhání ledvin je draze vykoupená maladaptivními systémovými důsledky extrémně vysokých koncentrací fosfatoninů – editorial
- ST2 a srdeční selhání: pouze další marker z rodiny nebo přeci jen něco více? – editorial
- Karotická stenóza – diagnostika a léčba – editorial
- Fallotova tetralogie dříve a dnes – editorial
- Regionální registr plicní embolie
- Antitrombotická léčba a nevarikózní krvácení do horní části gastrointestinálního traktu
- Výskyt ventilační poruchy plic u osob se silikózou a pneumokoniózou uhlokopa
- První české zkušenosti s lenalidomidem v terapii anemických nemocných s myelodysplastickým syndromem s delecí dlouhého ramene 5. chromozomu
- Vyšetřování tubulární resorpce fosfátů u pacientů s chronickým onemocněním ledvin
- Význam stanovení solubilního receptoru ST2 v diagnostice a prognostické stratifikaci pacientů se srdečním selháním
- Geriatrická multimorbidita – jeden z klíčových problémů současné medicíny
- Karotická stenóza – diagnostika a léčba
-
Studie PATHWAY-2: spironolakton vs placebo, bisoprolol a doxazosin ke stanovení optimální léčby hypertenze rezistentní na léky
Vysoká účinnost spironolaktonu ve snížení krevního tlaku u rezistentní hypertenze - Monoklonální imunoglobulin a kožní nemoci ze skupiny mucinóz – scleredema adultorum Buschke a scleromyxedema: popis 4 případů a přehled léčebných možností
- Nekorigovaná Fallotova tetralógia u 69-ročného pacienta
- Medicína na polární stanici v Antarktidě
- Vladislav Hytych. VATS lobektomie…krok za krokem
- Ventilace plic u osob se silikózou a pneumokoniózou uhlokopa – editorial
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Karotická stenóza – diagnostika a léčba
- Geriatrická multimorbidita – jeden z klíčových problémů současné medicíny
- Fallotova tetralogie dříve a dnes – editorial
- Vyšetřování tubulární resorpce fosfátů u pacientů s chronickým onemocněním ledvin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



