-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nejnovější možnosti systémové léčby u pacientů s metastazujícím karcinomem prostaty
Current systemic treatment of metastatic prostate cancer
In patients with advanced, metastastic prostate cancer systemic therapy is indicated. At initial diagnosis, these patients are treated with androgen-deprivation therapy in order to lower androgen-levels at castration-level. This treatment initially can be combined with docetaxel chemotherapy, especially in patients with higher tumor burden. If prostate cancer progresses despite adequate castration level of androgens, we speak of castration-resistant prostate cancer. In the background of rapidly evolving new treatment options for castration-resistant prostate cancer - namely abiraterone, enzalutamide, cabazitaxel, radium-223-dichloride - the approval criteria and side-effect profile have to be taken into account. The following article summarizes curent systemic treatment options for metastatic hormone-naïve and castration-resistant prostate cancer.
Key words:
metastatic castration-resistant prostate cancer, docetaxel, abiraterone, enzalutamide, cabazitaxel, radium-223-dichloride, chemohormonal therapy
Autoři: M. M. Heck; H. Kübler; J. E. Gschwend; M. Retz
Vyšlo v časopise: Urol List 2015; 13(1): 8-12
Souhrn
U pacientů s metastazujícím karcinomem prostaty v pokročilém stadiu je indikována systémová terapie. Po diagnostikování onemocnění je zahájena androgenní deprivační léčba s cílem snížit hodnotu androgenů na kastrační hladinu. Tuto léčbu lze kombinovat s chemoterapií na bázi docetaxelu, zejména u pacientů s tumory o větším objemu. Pokud dojde k progresi karcinomu i navzdory dostatečné kastrační hladině androgenů, hovoříme o karcinomu prostaty rezistentním na kastrační léčbu. V současné době, kdy se objevují stále nové přípravky pro léčbu karcinomu prostaty rezistentního na kastraci (abirateron, enzalutamid, kabazitaxel, chlorid radnatý 223), je nezbytné zohlednit registrační kritéria a profil nežádoucích účinků. Tento článek poskytuje přehled současných možností pro systémovou léčbu metastazujícího karcinomu prostaty, který dosud nebyl léčen hormonálně, a karcinomu prostaty rezistentního na kastraci.
Klíčová slova:
metastazující karcinom prostaty rezistentní na kastrační léčbu, docetaxel, abirateron, enzalutamid, kabazitaxel, chlorid radnatý-223, kombinace chemoterapie a hormonální léčbyÚvod
Karcinom prostaty představuje s 26% incidencí nejčastější solidní nádorové onemocnění u mužů. Incidence tohoto onemocnění v Evropě neustále stoupá, v současné době činí 214/100 000 mužů. Při diagnostikování onemocnění jsou přibližně u 9 % pacientů přítomny metastázy a u 27–54 % pacientů dojde po kurativní léčbě k recidivě [1]. U pacientů s lokální recidivou je možné kurativní léčbu opakovat, pacienti s metastazujícím onemocněním však vyžadují systémovou léčbu v podobě androgenní deprivační terapie. U pacientů s větším objemem metastáz ve stadiu senzitivním na hormonální léčbu lze terapii doplnit chemoterapií na bázi docetaxelu. V případě, že během androgenní deprivační terapie dojde (navzdory kastrační hladině testosteronu) k progresi karcinomu, hovoříme o karcinomu prostaty rezistentním na kastrační léčbu (CRPC) (viz definice CRPC).
Tento článek prezentuje nejnovější údaje týkající se chemoterapeutické léčby metastazujícího karcinomu prostaty senzitivního na hormonální léčbu a karcinomu prostaty rezistentního na kastraci a uvádí nejnovější poznatky o systémové léčbě CRPC.
Definice karcinomu prostaty rezistentního na kastrační léčbu (CRPC) [1]
Kastrační hladina testosteronu (testosteron < 50 ng/dl nebo < 1,7 nmol/l) a
- tři po sobě jdoucí zvýšení hladiny PSA (v rozmezí alespoň jednoho týdne) se dvěma zvýšeními o více než 50 % nad nadir > 2 ng/ml nebo
- radiograficky potvrzená progrese se dvěma nebo více kostními metastázami na kostním scintigramu nebo zvětšení objemu metastáz do měkkých tkání podle kritérií RECIST (response evaluation criteria in solid tumors).
Metastazující karcinom prostaty senzitivní na hormonální léčbu
Primární hormonální terapie v kombinaci s chemoterapií na bázi docetaxelu
Na výroční konferenci Americké onkologické společnosti byly prezentovány výsledky studie fáze III z roku 2014 týkající se primární hormonální terapie v kombinaci s chemoterapií při léčbě hormonálně senzitivního karcinomu prostaty (studie CHAARTED) [2]. Celkem 790 pacientů s metastazujícím karcinomem prostaty senzitivním na hormonální léčbu bylo randomizováno v poměru 1 : 1 k androgenní deprivaci a šesti cyklům chemoterapie na bázi docetaxelu v třítýdenním režimu (75 mg/m2) nebo pouze androgenní deprivaci (kontrolní větev).
Ve větvi testující primární hormonální terapii + chemoterapii byla prokázána významně delší doba přežití než v kontrolní větvi – 57,6 vs 44 měsíce (poměr rizik 0,61; p = 0,0003). Analýza podskupin prokázala větší benefit u pacientů s větším objemem metastáz (viscerální metastázy a/nebo ≥ 4 kostní metastázy). Zatímco v podskupině pacientů s menším objemem metastáz nebylo dosud dosaženo mediánu doby přežití (v obou větvích), v podskupině pacientů s větším objemem metastáz byl zaznamenán významnější benefit v době přežití než v kontrolní větvi – 49,2 vs 32,2 měsíce (poměr rizik 0,60; p = 0,0006).
Primární hormonální terapie v kombinaci s chemoterapií vykazuje dosud největší benefit v době přežití v rámci systémové léčby metastazujícího karcinomu prostaty.
Tuto modalitu lze zvážit především u pacientů s karcinomem ve stadiu senzitivním na hormonální léčbu s větším objemem metastáz.
Karcinom prostaty rezistentní na kastrační léčbu, který nebyl dosud léčen pomocí chemoterapie
Abirateron
Abirateron je steroidní inhibitor biosyntézy androgenů, který selektivně inhibuje androgenní syntézu esenciálního enzymu CYP-17 (17α-hydroxyláza a C17,20-lyáza). Blokáda těchto enzymů způsobuje supresi syntézy androgenů v testikulární tkáni, tkáni nadledvin i tkáni samotného tumoru.
Abirateron se podává perorálně v dávce 1 000 mg denně v kombinaci s prednisonem 10 mg denně.
V roce 2013 byl abirateron schválen pro léčbu pacientů s metastazujícím karcinomem prostaty rezistentním na kastrační léčbu (mCRPC), kteří ještě nepodstoupili chemoterapii (studie COU-AA-302) (tab. 1) [3]. Celkem 1 088 pacientů bylo v poměru 1 : 1 randomizováno k léčbě abirateronem (1 000 mg abirateron + dvakrát 5 mg prednison) nebo do kontrolní větve (placebo + dvakrát 5 mg prednison). Studie byla předčasně odslepena na základě interim analýzy, protože hodnocení primárních i sekundárních cílových parametrů prokázalo benefit u pacientů užívajících abirateron.
Tab. 1. Přehled randomizovaných studií fáze III, které testují nové preparáty u pacientů s mCRPC, kteří dosud nepodstoupili chemoterapii. 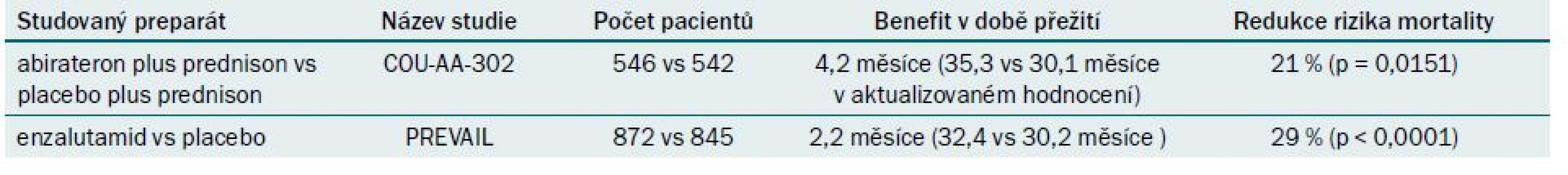
Primární cílový parametr „doba přežití bez radiografické progrese“ byl významně lepší u pacientů léčených abirateronem (první publikace: p < 0,0001; 8,3 měsíce v kontrolní skupině vs u pacientů užívajících abirateron nebylo cílového parametru dosud dosaženo, aktualizované hodnocení [4]: p < 0,0001; 8,2 měsíce v kontrolní skupině vs 16,5 měsíce u pacientů léčených abirateronem), zatímco s ohledem na druhý primární cílový parametr „celková doba přežití“ byl zaznamenán nesignifikantní trend ve prospěch léčby pomocí abirateronu (první publikace: p < 0,00097; 27,2 měsíce v kontrolní skupině vs cílového parametru nebylo dosud dosaženo u pacientů užívajících abirateron, aktualizované hodnocení [4]: p = 0,0151; 30,1 měsíce v kontrolní skupině vs 35,3 měsíce u pacientů léčených abirateronem).
Nejčastější vedlejší účinky související s léčbou pomocí abirateronu zahrnovaly především nežádoucí příhody v důsledku působení minerálkortikoidů (stupeň 1–4), hypertenzi (22 %), hypokalemii (17 %), periferní otok (28 %). Ve většině případů se však jednalo o komplikaci nízkého stupně (stupeň 1–2).
U pacientů užívajících abirateron byl dále zaznamenán častější výskyt komplikací souvisejících s přechodným zvýšením transamináz (stupeň 3–4) (8 vs 3 % v kontrolní skupině).
Abirateron je vhodným preparátem pro perorální léčbu pacientů s mCRPC, kteří dosud nepodstoupili žádnou chemoterapii. Tato terapie je spojena s malým výskytem nežádoucích účinků. Mezi kontraindikace patří zejména již existující insuficience jater, hypertenze a akutní hypokalemie.
Enzalutamid
Enzalutamid je antagonistou androgenního receptoru, který inhibuje vazbu na androgenní receptor, a tak blokuje jeho translokaci v buněčném jádru a inhibuje interakci mezi androgenním receptorem a DNA.
Enzalutamid se podává perorálně v dávce 160 mg denně. Současné podávání prednisonu není nutné.
Enzalutamid byl v roce 2014 na základě úspěšné studie fáze III (PREVAIL) (tab. 1) schválen pro léčbu mCRPC u pacientů, kteří dosud nepodstoupili chemoterapii [5]. Celkem 1 717 pacientů bylo randomizováno v poměru 1 : 1 k užívání enzalutamidu (160 mg enzalutamidu) nebo placebu. Studie byla předčasně odslepena na základě interim analýzy po 540 úmrtích vzhledem k tomu, že analýza primárních výsledných parametrů prokázala benefit při léčbě enzalutamidem. U pacientů léčených pomocí enzalutamidu byl zaznamenán benefit primárního výsledného parametru „celková doba přežití“ (30,2 měsíce placebo vs 32,4 měsíce enzalutamid) a redukce rizika mortality o 29 % (poměr rizik 0,71; p < 0,0001). Rovněž v případě druhého výsledného parametru (doba přežití bez radiografické progrese) byl prokázán benefit při léčbě enzalutamidem (3,9 měsíce placebo vs mediánu doby přežití bez radiografické progrese nebylo ve větvi testující enzalutamid dosaženo) a 81% redukce rizika, že dojde k radiografické progresi nebo úmrtí (poměr rizik 0,19; p < 0,0001).
Nejčastější nežádoucí účinky (stupeň 1–4) při léčbě enzalutamidem zahrnovaly únavu (36 vs 26 % placebo) a hypertenzi (13 vs 4 % v placebo).
Enzalutamid je vhodným preparátem pro léčbu pacientů s mCRPC, kteří dosud nepostoupili chemoterapii. Tato terapie je spojena s malým výskytem nežádoucích účinků. Na rozdíl od testování abirateronu byli do registrační studie zařazeni rovněž pacienti s viscerálními metastázami a účinnost léčby byla prokázána i v této podskupině pacientů.
Chemoterapie na bázi docetaxelu v rámci léčby první linie karcinomu prostaty rezistentního na kastrační léčbu
Aplikace docetaxelu v rámci léčby první linie představuje od roku 2004 standardní modalitu pro léčbu mCRPC. Dvě nezávislé randomizované studie fáze III (TAX 327, SWOG S9916) prokázaly účinnost chemoterapie na bázi docetaxelu se statisticky významným benefitem v době přežití (o přibližně tři měsíce) ve srovnání s kontrolní skupinou užívající mitoxantron v kombinaci s prednisonem [6,7].
Ačkoli v registrační studii byl docetaxel podáván v dávce 75 mg/m2 v třítýdenním režimu, nejnovější údaje ze studie fáze III prokazují větší benefit při dávkování 50 mg/m2 ve dvoutýdenním režimu [8]. V rámci této studie bylo 361 pacientů randomizováno v poměru 1 : 1 k užívání docetaxelu ve dvoutýdenním a třítýdenním režimu (kontrolní větev). V obou větvích byla léčba doplněna aplikací 10 mg prednisonu denně. Jako primární výsledný parametr byl stanoven interval do selhání léčby definovaný jako progrese tumoru (biochemická progrese nebo progrese prokázaná pomocí zobrazovacího vyšetření), úmrtí pacienta, výskyt nepřijatelných vedlejších účinků nebo ukončení chemoterapie bez bližšího udání důvodu.
Při dvoutýdenním léčebném režimu byl prokázán malý, ovšem signifikantní benefit v intervalu do selhání léčby 5,6 vs 4,9 měsíce při třítýdenním režimu (poměr rizik 1,3; p = 0,014). Dvoutýdenní terapeutický protokol dosahoval lepších výsledků rovněž s ohledem na sekundární výsledný parametr „celkové doby přežití“, 19,5 vs 17 měsíců (poměr rizik 1,4; p = 0,021).
Je třeba zdůraznit, že dvoutýdenní protokol byl spojen s příznivějším profilem nežádoucích účinků než třítýdenní protokol. Byl zaznamenán pokles toxicity 3.–4. stupně: výskyt neutropenie 36 vs 53 %, leukopenie 13 vs 29 % a febrilní neutropenie 4 vs 14 %. Infekce v kombinaci s neutropenií se vyskytovala významně méně často při užití dvoutýdenního protokolu, 6 vs 24 % (p = 0,002).
Výsledky studií fáze III potvrzují při léčbě mCRPC pomocí docetaxelu benefit dvoutýdenního terapeutického protokolu (50 mg/m2), který je rovněž spojen s menším výskytem komplikací oproti třítýdennímu protokolu (75 mg/m2).
Léčba karcinomu prostaty rezistentního na kastrační léčbu u pacientů, kteří již podstoupili léčbu docetaxelem
Alpharadin (chlorid radnatý 223)
Alpharadin (chlorid radnatý 223) je vysoce energetický alfa-zářič s malým dosahem několika milimetrů, který se na základě své podobnosti s vápníkem váže do kosti. Tento preparát se akumuluje primárně v oblastech se zvýšenou kostní přestavbou (což je případ kostních metastáz, kde může selektivně působit).
V rámci registrační studie bylo radiofarmaceutikum podáváno pacientům se symptomatickým mCRPC s alespoň dvěma prokázanými kostními metastázami, ovšem bez viscerálních metastáz (studie ALSYMPCA) (tab. 2) [9]. Do studie byli zařazeni pacienti, kteří podstoupili chemoterapii na bázi docetaxelu, nebo pacienti, kteří nebyli vhodnými kandidáty pro tuto léčbu nebo ji odmítli. Celkem 922 pacientů bylo v poměru 2 : 1 randomizováno k aktivní léčbě nebo placebu.
Tab. 2. Přehled randomizovaných studií fáze III, které testují nové preparáty u pacientů s mCRPC, kteří již podstoupili chemoterapii na bázi docetaxelu. 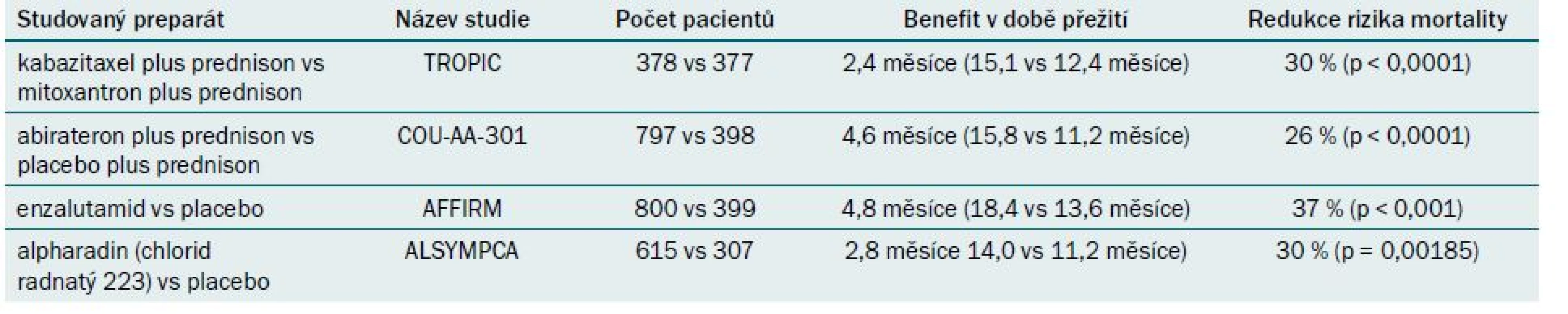
Alpharadin se podával intravenózně v infuzi v šesti dávkách v intervalu čtyř týdnů (50 kBq/kg i.v.).
Na základě interim analýzy (s hodnocením 809 pacientů) byla studie vzhledem k dosažení cílových parametrů předčasně odslepena. Celkem 445 z 809 hodnocených pacientů (58 %) již podstoupilo léčbu docetaxelem. Při odslepení studie byl u pacientů podstupujících léčbu pomocí alpharadinu prokázán benefit v době přežití 2,8 měsíce (14,0 vs 11,2 měsíce) a pokles rizika mortality o 30 % (p = 0,00185). Aktualizovaná analýza zahrnující 921 pacientů (radium-223 n = 614; placebo n = 307) prokázala prodloužení benefitu v době přežití na 3,6 měsíce (14,9 vs 11,3 měsíce) [10].
Léčba pomocí alpharadinu vykazovala pouze mírné myelosupresivní nežádoucí účinky. U 2,2 % pacientů se vyskytla neutropenie 3./4. stupně a u 6,3 % pacientů trombocytopenie 3./4. stupně.
Alpharadin je vhodným preparátem (s alfa-zářičem) pro intravenózní léčbu pacientů s mCRPC. Tato terapie je spojena s malým výskytem nežádoucích účinků. Využití tohoto preparátu je omezeno na pacienty se symptomatickými kostními metastázami, ovšem bez viscerálních metastáz. Tato terapie je vhodná jak pro pacienty, kteří již podstoupili chemoterapii na bázi docetaxelu, tak pro pacienty, u nichž je tato léčba nevhodná.
Znovuzahájení léčby docetaxelem
U pacientů, kteří dobře reagují na léčbu a docetaxel v rámci terapie první linie dobře snášejí, je možné v léčbě docetaxelem pokračovat (tj. ji znovu zahájit). V prospektivní studii fáze II byla léčba docetaxelem (75 mg/kg q3w) znovu zahájena u pacientů s mCRPC, u kterých byla v rámci léčby první linie zaznamenána redukce PSA o ≥ 50 % nebo ≤ 1 ng/ml [11]. Primárního výsledného parametru – opakovaného poklesu PSA o ≥ 50 % – bylo dosaženo u 11 z celkem 45 (25 %) pacientů. Medián doby do PSA progrese činil pět měsíců a medián celkové doby přežití při opakovaném zahájení léčby docetaxelem 13 měsíců.
Nežádoucí účinky spojené s opakovaným zahájením léčby docetaxelem byly pouze mírné povahy. Mezi nejčastější projevy toxicity 1./2. stupně patřila neutropenie u 18 pacientů (40 %), trombocytopenie u 11 pacientů (24,5 %), zvracení u osmi pacientů (17,8 %) a periferní neuropatie u šesti pacientů (13,3 %).
Retrospektivní studie, kterou uskutečnila Technická univerzita v Mnichově, ukázala, že pokles PSA o ≥ 50 % v rámci léčby první linie lze považovat za adekvátní indikátor odpovědi na léčbu docetaxelem při znovuzahájení terapie [12]. Do analýzy bylo zařazeno celkem 44 pacientů s mCRPC, kteří podstoupili léčbu první linie s aplikací docetaxelu i opakovanou léčbu docetaxelem v třítýdenním protokolu (75 mg/kg). Z různých studovaných definic pro PSA odpověď korelovala pouze ≥ 50% redukce PSA při chemoterapii první linie s významně lepší dobou přežití bez biochemické progrese (5,8 vs 4,5 měsíce; p = 0,01) a celkovou dobou přežití (22,1 vs 7,2 měsíce; p = 0,03) při znovuzahájení léčby docetaxelem.
Kabazitaxel
Kabazitaxel patří mezi deriváty taxanů druhé generace. Tento preparát inhibuje depolymerizaci mikrotubulů, a tedy buněčné dělení. Podává se v dávce 25 mg/m2 i.v. ve třítýdenním režimu.
V rámci registrační studie testující kabazitaxel bylo 755 pacientů s mCRPC, kteří již podstoupili léčbu docetaxelem, randomizováno v poměru 1 : 1 k léčbě pomocí kabazitaxelu plus prednisonu a srovnávací léčbě pomocí mitoxantronu plus prednisonu (studie TROPIC) (tab. 2) [13]. Výsledky odhalily benefit v době přežití o 2,4 měsíce ve prospěch léčby kabazitaxelem (15,1 měsíce u pacientů léčených pomocí kabazitaxelu vs 12,7 měsíce u pacientů léčených pomocí mitoxantronu). Nejčastější projevy toxicity 3./4. stupně zahrnovaly u pacientů léčených kabazitaxelem neutropenii (82 %) a průjem (6 %). Zdůraznit je třeba 8% míru výskytu febrilní neutropenie u pacientů léčených pomocí kabazitaxelu.
Kabazitaxel je jedinou v současné době dostupnou formou chemoterapie, u které byl prokázán benefit v době přežití po předchozí chemoterapii na bázi docetaxelu. Z důvodu vyšší míry výskytu neutropenie je využití tohoto přípravku limitováno u pacientů s insuficiencí kostní dřeně. Pacientům s vyšším rizikem (např. intermitentní neutropenie při předchozí chemoterapii docetaxelem) lze profylakticky podávat růstové faktory stimulující granulocytární kolonie – G-SFC.
Abirateron
V rámci registrační studie testující abirateron bylo 1 195 pacientů s mCRPC, kteří již podstoupili léčbu docetaxelem, randomizováno v poměru 2 : 1 k léčbě pomocí abirateronu plus prednisonu a srovnávací léčbě pomocí placeba plus prednisonu (studie COU-AA-301) (tab. 2) [14].
Studie byla na základě výsledků interim analýzy po mediánu sledování 12,8 měsíce odslepena, protože výsledných cílových parametrů bylo dosaženo předčasně. U pacientů léčených abirateronem bylo ve srovnání s placebem zjištěno zlepšení celkové doby přežití o 3,9 měsíce (medián) a 35% redukce rizika mortality. Závěrečná analýza prokázala u pacientů léčených pomocí abirateronu prodloužení benefitu v době přežití dokonce na 4,6 měsíce.
U pacientů léčených abirateronem byla zaznamenána pouze mírná toxicita v podobě nežádoucích účinků v důsledku působení minerálkortikoidů, jako např. retence tekutin a edém (31 %), hypertenze (10 %) a hypokalemie (17 %).
Abirateron je vhodným preparátem pro perorální léčbu pacientů s mCRPC, kteří již postoupili chemoterapii na bázi docetaxelu. Tato terapie je spojena s malým výskytem nežádoucích účinků. Stejně jako v případě bez předchozí chemoterapie je užití preparátu limitováno u pacientů s jaterní insuficiencí, hypertenzí a akutní hypokalemií.
Enzalutamid
V rámci registrační studie testující enzalutamid u pacientů s mCRPC, kteří podstoupili chemoterapii na bázi docetaxelu, bylo 1 199 pacientů randomizováno v poměru 2 : 1 k aktivní léčbě a placebu v dvojitě zaslepené studii (Studie AFFIRM) (tab. 2) [15].
Studie byla odslepena na základě interim analýzy po 520 úmrtích, protože výsledných parametrů bylo dosaženo předčasně. U pacientů léčených pomocí enzalutamidu bylo prokázáno zlepšení celkové doby přežití (medián) o 4,8 měsíce (18,4 vs 13,6 měsíce) a pokles rizika mortality o 37 % (p < 0,001).
Je třeba zdůraznit, že u pacientů léčených pomocí enzalutamidu byl zaznamenán menší výskyt nežádoucích účinků toxicity 3./4. stupně (45,3 vs 53,11 %). Při aktivní léčbě byl zaznamenán častější výskyt únavy, průjmu a návalů horka. Dále byl u pacientů léčených pomocí enzalutamidu zaznamenán výskyt epileptických záchvatů (5 z 800 pacientů (0,6 %) vs 0 z 800 pacientů (0 %)).
Enzalutamid je vhodným preparátem pro perorální léčbu pacientů s mCRPC, kteří již postoupili chemoterapii na bázi docetaxelu. Tato terapie je spojena s malým výskytem nežádoucích účinků. Doporučuje se zvýšená pozornost při podávání léčiva pacientům s anamnézou epilepsie nebo predispozicemi k epileptickým záchvatům. Mezi predispozice patří mozková příhoda, metastázy do mozku, zneužívání alkoholu nebo současná medikace snižující práh vzniku epileptických záchvatů.
Závěr
U pacientů s karcinomem prostaty v hormonálně senzitivním stadiu dosahuje primární léčba v podobě kombinace hormonální terapie a chemoterapie na bázi docetaxelu zřejmého benefitu v době přežití, zejména u jedinců s větším objemem metastáz. Při volbě nejvhodnějšího preparátu pro léčbu karcinomu prostaty rezistentního na kastrační léčbu je v současné době, kdy se objevují stále nové přípravky, nezbytné zohlednit registrační kritéria a profil nežádoucích účinků. Jeden z nejnáročnějších úkolů spočívá ve správném načasování podávání medikamentu v rámci terapeutického protokolu. Abirateron i enzalutamid byly schváleny pro perorální léčbu (s minimálním výskytem vedlejších účinků) mCRPC u pacientů, kteří dosud nepostoupili léčbu pomocí chemoterapie. V současné době jsou k dispozici čtyři preparáty pro léčbu mCRPC po aplikaci docetaxaxelu v rámci léčby první linie, které přinášejí benefit v době přežití: abirateron, alpharadin (chlorid radnatý 223), enzalutamid a kabazitaxel.
Dr. med. Matthias Heck
Klinik und Poliklinik für Urologie
Klinikum rechts der Isar
Technische Universität München
Ismaninger Str. 22
81675 München
m.heck@lrz.tum.de
Zdroje
1. Heidenreich A, Bastian PJ, Bellmunt J et al. EAU guidelines on prostate cancer. Part II: Treatment of advanced, relapsing, and castration-resistant prostate cancer. Eur Urol 2014; 65(2): 467–479. doi: 10.1016/j.eururo.2013.11.002.
2. Sweeney C, Chen YH, Carducci MA et al. Impact on overall survival (OS) with chemohormonal therapy versus hormonal therapy for hormone-sensitive newly metastatic prostate cancer (mPrCa): An ECOG-led phase III randomized trial. J Clin Oncol 2014; 32 (5 Suppl): LBA2.
3. Ryan CJ, Smith MR, de Bono JS et al. Abiraterone in metastatic prostate cancer without previous chemotherapy. N Engl J Med 2013; 368(2): 138–148. doi: 10.1056/NEJMoa1209096.
4. Rathkopf DE, Smith MR, de Bono JS et al. Updated interim efficacy analysis and long-term safety of abiraterone acetate in metastatic castration-resistant prostate cancer patients without prior chemotherapy (COU-AA-302). Eur Urol 2014; 66(5): 815–825. doi: 10.1016/j.eururo.2014.02.056.
5. Beer TM, Armstrong AJ, Rathkopf DE et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014; 371(5): 424–433. doi: 10.1056/NEJMoa1405095.
6. Petrylak DP, Tangen CM, Hussain MH et al. Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer. N Engl J Med 2004; 351(15): 1513–1520.
7. Tannock IF, de Wit R, Berry WR et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med 2004; 351(15): 1502–1512.
8. Kellokumpu-Lehtinen PL, Harmenberg U, Joensuu T et al. 2-weekly versus 3-weekly docetaxel to treat castration-resistant advanced prostate cancer: a randomised, phase 3 trial. Lancet Oncol 2013; 14(2): 117–124. doi: 10.1016/S1470-2045(12)70537-5.
9. Parker C, Nilsson S, Heinrich D et al. Alpha emitter radium-223 and survival in metastatic prostate cancer. N Engl J Med 2013; 369(3): 213–223. doi: 10.1056/NEJMoa1213755.
10. Parker C, Coleman RE, Nilsson S et al. Updated survival, quality of life (QOL) and safety data of radium-223 chloride (RA-223) in patients with castration-resistant prostate cancer (CRPC) with bone metastases from the phase 3 double-blind, randomized, multinational study (ALSYMPCA). Ann Oncol 2012; 23: ix294.
11. Di Lorenzo G, Buonerba C, Faiella A et al. Phase II study of docetaxel re-treatment in docetaxel-pretreated castration-resistant prostate cancer. BJU Int 2011; 107(2): 234–239. doi: 10.1111/j.1464-410X.2010.09498.x.
12. Heck MM, Thalgott M, Retz M et al. Rational indication for docetaxel rechallenge in metastatic castration-resistant prostate cancer. BJU Int 2012; 110(11 Pt B): E635–E640. doi: 10.1111/j.1464-410X.2012.11364.x.
13. de Bono JS, Oudard S, Ozguroglu M et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 2010; 376(9747): 1147–1154. doi: 10.1016/S0140-6736(10)61389-X.
14. de Bono JS, Logothetis CJ, Molina A et al. Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 2011; 364(21): 1995–2005. doi: 10.1056/NEJMoa1014618.
15. Scher HI, Fizazi K, Saad F et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 2012; 367(13): 1187–1197.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2015 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Endourologické řešení striktury ureterální a ureteroenterické anastomózy
- Přístupy k perkutánní nefrolitotomii u pacientů s renálním angiomyolipomem
- Čichová detekce karcinomu prostaty pomocí speciálně trénovaného psa ve vzorcích lidské moči
- MikroRNA v patogenezi renálního karcinomu a jejich využití pro stanovení diagnózy a prognózy RCC
- Editorial
- Operace varikokély a její dopad na kvalitu spermiogramu
- Infertilita při azoospermii a dosažení gravidity
- Leiomyosarkom ledviny u gravidní pacientky – kazuistika
- Solitární metastáza karcinomu prostaty do penisu
- Guidelines pro léčbu karcinomu prostaty 4. část
-
Aktivní sledování jako prostředek pro omezení nadbytečné léčby karcinomu prostaty s nízkým rizikem:
novinky z posledního kongresu Americké urologické asociace (2014) - Nejnovější možnosti systémové léčby u pacientů s metastazujícím karcinomem prostaty
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Operace varikokély a její dopad na kvalitu spermiogramu
- Guidelines pro léčbu karcinomu prostaty 4. část
- Infertilita při azoospermii a dosažení gravidity
- Endourologické řešení striktury ureterální a ureteroenterické anastomózy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



