-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Guidelines EAU pro léčbu mužské infertility
5. Obstrukční azoospermie
Autoři: A. Jungwirth; T. Diemer; G. R. Dohle; A. Giwercman; Z. Kopa; C. Krausz; H. Tournaye
Vyšlo v časopise: Urol List 2012; 10(4): 59-63
Kategorie: Guidelines
© European Association of Urology 2012
4. Genetické poruchy u infertilních mužů
5. Obstrukční azoospermie
5.1 Definice
Obstrukční azoospermie značí absenci spermií a spermatogenetických buněk v ejakulátu a moči po ejakulaci v důsledku bilaterální obstrukce semenných vývodů. Obstrukční azoospermie je méně častá než NOA a vyskytuje se u 15–20 % mužů s azoospermií. Nejčastější příčiny obstrukční azoospermie jsou uvedeny v tab. 7.
Tab. 1. Klasifikace OA na základě (vrozené/získané) obstrukce kanálků. 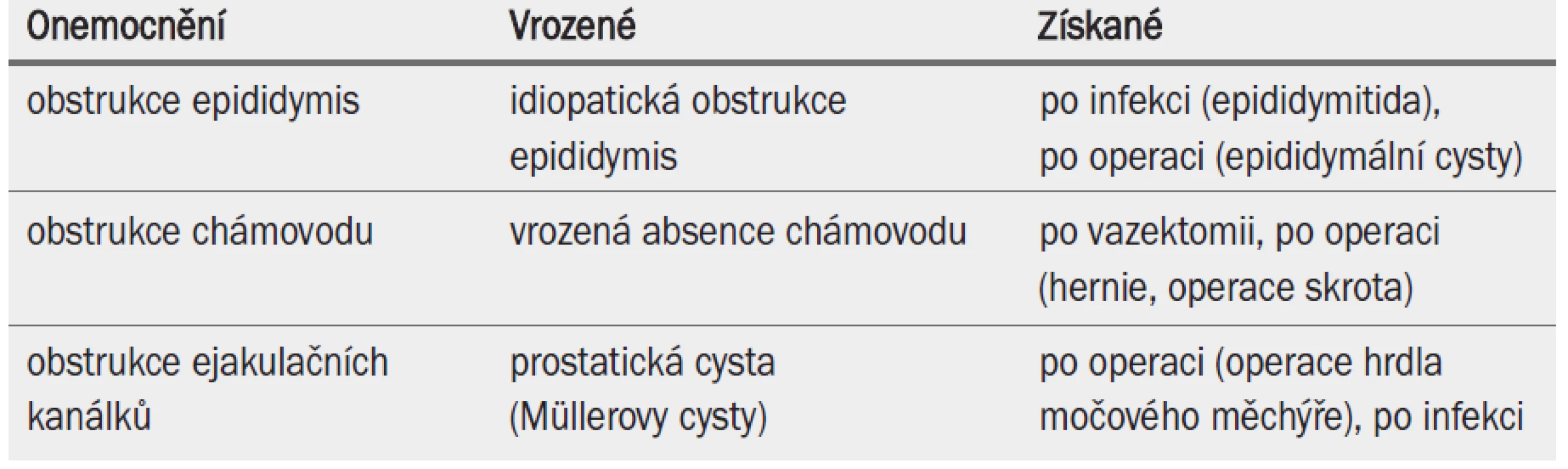
Muži s obstrukční azoospermií mají normální hladinu FSH, varlata normální velikosti a zvětšená nadvarlata. V některých případech může chybět chámovod, a to následkem vrozené příčiny nebo po předchozí operaci třísla nebo skrota. U mužů trpících primární infertilitou se obstrukce většinou vyskytuje v oblasti epididymis, ale může se vyskytnout i v ejakulačních kanálcích a chámovodu.
U 25 % mužů s podezřením na obstrukci nejsou během vyšetření skrota zjištěna žádná spermatozoa v nadvarleti, což ukazuje na intratestikulární obstrukci.
5.2 Klasifikace
5.2.1 Intratestikulární obstrukce
Intratestikulární obstrukce se vyskytuje u 15 % pacientů s OA [1]. Vrozené formy (absence spojení mezi rete testis a odvodnými kanálky) jsou méně časté než získané formy (tj. obstrukce v důsledku zánětu nebo traumatu). Druhá forma často souvisí s obstrukcí epididymis a chámovodu.
5.2.2 Obstrukce epididymis
Obstrukce epididymis je nejčastější příčinou obstrukční azoospermie postihující 30–67 % mužů s azoospermií s hodnotou FSH v séru nižší než je dvojnásobek horní hranice normy [1–4].
Vrozená obstrukce epididymis se obvykle projevuje CBAVD, což je v 82 % případů spojeno s minimálně jednou mutací genu cystické fibrózy [5]. Tato forma je často doprovázena absencí distální části nadvarlete a agenezí semenného váčku (viz kap. 4 Genetické poruchy u infertilních mužů). Ostatní vrozené formy obstrukce (absence spojení mezi odvodnými kanálky a corpus epididymis, ageneze/atresie krátké části epididymis) jsou velmi vzácné. Vrozené formy také zahrnují chronickou in-fekci plicních sinů (Youngův syndrom) [6], kdy obstrukce vzniká následkem mechanické blokády průsvitu proximální části nadvarlete.
Mezi získané formy patří nejčastěji sekundární onemocnění vzniklé následkem akutní (např. gonokokové) a subklinické (např. chlamydiové) epididymitidy [7,8] (viz kapitola 11 Infekce mužských přídatných žláz). Akutní či chronická traumata mohou mít rovněž za násle-dek poškození nadvarlete [9]. Po operačním výkonu na nadvarleti, např. odstranění epididymální cysty, může dojít k azoospermii.
V případě korekce průchodnosti semenných vývodů je třeba vzít v úvahu obstrukci epididymis způsobenou dlouhotrvající distální překážkou [10].
5.2.3 Obstrukce chámovodu
Obstrukce chámovodu je nejčastější příčinou získané obstrukce po vazektomii provedené z důvodu sterilizace, při níž může potenciálně dojít k narušení zárodečných buněk a fibróze [11,12]. Asi 2–6 % mužů si vyžádá zrušení vazektomie. U 5–10 % mužů, kteří prodělali vazovazostomii, došlo ke vzniku obstrukce epididymis způsobené prasknutím tubulu; v těchto případech je nezbytné provedení epididymovazostomie (viz kap. 10 Mužská antikoncepce). K obstrukci chámovodu může dojít rovněž po herniotomii [13]. Hernioplastika s užitím polypropylenové síťky vyvolává fibroblastickou reakci vedoucí k zavzetí nebo uzavření chámovodu [14].
Nejčastější formou vrozené obstrukce chámovodu je CBAVD, často doprovázená cystickou fibrózou. Unilaterální ageneze nebo částečný defekt je spojen s kontralaterálními anomáliemi semenných váčků v 80 % nebo renální agenezí ve 26 % případů [15] (viz kap. 4 Genetické poruchy u infertilních mužů). Distální obstrukce chámovodu zahrnuje CBAVD a nechtěné poranění chámovodu během operace hernie [16].
5.2.4 Obstrukce ejakulačních kanálků
Obstrukce ejakulačního vývodu je přítomna přibližně u 1–3 % pacientů s obstrukční azoospermií [1]. Toto onemocnění lze dále klasifikovat jako následek cysty nebo zánětu. Cystické obstrukce jsou většinou vrozené (např. cysta Müllerova vývodu nebo cysta urogenitálního sinu/ejakulačního vývodu) a jsou lokalizovány v prostatě mediálně mezi ejakulačními vývody. U anomálií urogenitálního sinu se jeden nebo oba ejakulační vývody vyprazdňují do cysty [17], zatímco u anomálií Müllerova vývodu jsou ejakulační vývody dislokovány laterálně a stlačeny cystou [18].
Paramediální nebo laterální intra-prostatické cysty pocházejí z Wolfova vývodu a v klinické praxi se vyskytují zřídka [19]. Pozánětlivé obstrukce ejakulačních vývodů vznikají většinou v důsledku akutní, neakutní či chronické uretroprostatitidy [20]. Vrozená nebo získaná kompletní obstrukce ejakulačních vývodů je většinou spojena s malým objemem ejakulátu, sníženou hladinou fruktózy v ejakulátu nebo její úplnou absencí a kyselým pH. Semenné váčky jsou obvykle dilatovány (předozadní průměr > 15 mm) [20,21].
5.2.5 Funkční obstrukce distální části semenných vývodů
Funkční obstrukce distální části semenných vývodů může být připisována lokální neuropatii [22]. Z důvodu vazografického nálezu ampulovezikulární atonie nebo hypertonie ejakulačních kanálků tato abnormalita často souvisí s urodynamickou dysfunkcí. Přestože byla funkční obstrukce distální části semenných váčků pozorována u pacientů trpících juvenilním diabetem a polycystickým onemocněním ledvin [23], nebyla ve většině popsaných případů zjištěna žádná významná patologie. Výsledky analýzy ejakulátu mohou prokázat azoospermii, kryptozoospermii nebo závažný syndrom OAT.
5.3 Diagnostika
5.3.1 Klinická anamnéza
Odběr klinické anamnézy by se měl řídit doporučením pro vyšetření infertilních mužů (viz kap. 2 Vyšetření).
Pacienta je třeba se dotázat na výskyt:
- hematospermie
- bolesti po ejakulaci
- prodělané či současné uretritidy nebo prostatitidy
- obstrukčních nebo dráždivých mikčních symptomů
- předchozího zvětšení, bolesti či operace skrota
- předchozí operace tříselné kýly nebo traumat
- chronických sinopulmonárních infekcí
5.3.2 Klinické vyšetření
Klinické vyšetření by se mělo řídit doporučením pro vyšetření infertilních mužů. Následující nálezy nasvědčují přítomnosti obstrukční azoospermie:
- alespoň jedno varle o objemu > 15 ml (ačkoli menší objem varlete může být zjištěn u některých pacientů s obstrukční azoospermií a průvodním parciálním testikulárním selháním)
- zvětšené a tuhé nadvarle
- uzlíky v epididymis nebo chámovodu
- absence či částečná atresie chámovodu
- symptomy uretritidy
- abnormality prostaty
5.3.3 Analýza ejakulátu
Podle doporučení WHO je třeba provést alespoň dvě vyšetření v intervalu 2–3 měsíců (viz kap. 2 Vyšetření). Azoospermie znamená absenci spermií po odstředění při zvětšení X 400. Po zkapalnění ejakulátu je nutné pečlivé opakované vyšetření několika nátěrů. V případě, že nejsou nalezena žádná spermatozoa ve vlhkém nátěru, je třeba poměrný zbytek nebo celý vzorek ejakulátu odstředit při 3 000 G po dobu 15 min. Peleta musí být vyšetřena na přítomnost spermatozoí.
Objem ejakulátu < 1,5 ml, kyselé pH a nízká hladina fruktózy svědčí o obstrukci ejakulačních vývodů nebo CBAVD. V případě malého objemu ejakulátu je zapotřebí prověřit výskyt spermatozoí v moči po ejakulaci, neboť jejich přítomnost prokazuje poruchu ejakulace. Absence spermatozoí a nález nezralých zárodečných buněk v nátěru z ejakulátu svědčí o možnosti úplné obstrukce proximální nebo distální části semenných vývodů.
5.3.4 Měření hormonálních hladin
Hladina FSH v séru může být normální, ale nevylučuje testikulární příčinu azoospermie (tj. zástavu spermatogeneze). Ve skutečnosti má 40 % mužů s primárním selháním spermatogeneze normální hladinu folikuly stimulujícího hormonu. Hladina inhibinu B má pravděpodobně vyšší hodnotu pro predikci normální spermatogeneze [4].
5.3.5 Ultrazvukové vyšetření
Ultrazvukové vyšetření skrota může být užitečné při zjišťování symptomů obstrukce (např. dilatace rete testis, zvětšené epididymis s cystickými lézemi a absencí chámovodu) a známek testikulární dysgeneze (např. nehomogenní testikulární struktura a mikrokalcifikace) a při detekci souvisejícího testikulárního carcinoma in situ. U všech pacientů s malým objemem ejakulátu a u pacientů s podezřením na distální obstrukci je nezbytné provedení transrektálního ultrazvukového vyšetření (TRUS), pokud možno při vysokém rozlišení a s použitím biplanárních vyšetřovacích sond o vysoké frekvenci (> 7 MHz). Zvětšení semenných váčků (předozadní průměr 15 mm) [21] a anechogenní okrouhlé oblasti v místě semenných váčků [24] detekované pomocí TRUS jsou anomálie často související s obstrukcí ejakulačního vývodu, zvláště pokud je objem ejakulátu < 1,5 ml. Další známé anomálie vyskytující se v případech obstrukční azoospermie jsou cysty Müllerova vývodu nebo cysty urogenitálního sinu/ejakulačních vývodů [20] a kalcifikace ejakulačních vývodů [25]. TRUS se užívá rovněž k odsávání tekutiny ze semenných váčků [26].
Invazivní diagnostické výkony zahrnující biopsii varlete, revizi obsahu skrota a vyšetření distální části semenných vývodů jsou indikovány u všech pacientů s obstrukční azoospermií s podezřením na získanou obstrukci semenných vývodů. Doporučuje se provést současně explorativní a rekonstrukční operaci.
5.3.6 Testikulární biopsie
Testikulární biopsie může být v některých případech indikována pro vyloučení selhání spermatogeneze. Během stejné chirurgické procedury je také možné provést extrakci spermií z varlete (TESE) pro kryoprezervaci a pozdější ICSI, pokud nelze provést chirurgickou rekanalizaci nebo pokud tato metoda selhala.
V tab. 8 je uvedena bodovací škála pro hodnocení testikulární biopsie [27].
Tab. 2. Bodovací škála pro hodnocení testikulární biopsie (Johnsenovo skóre)*. 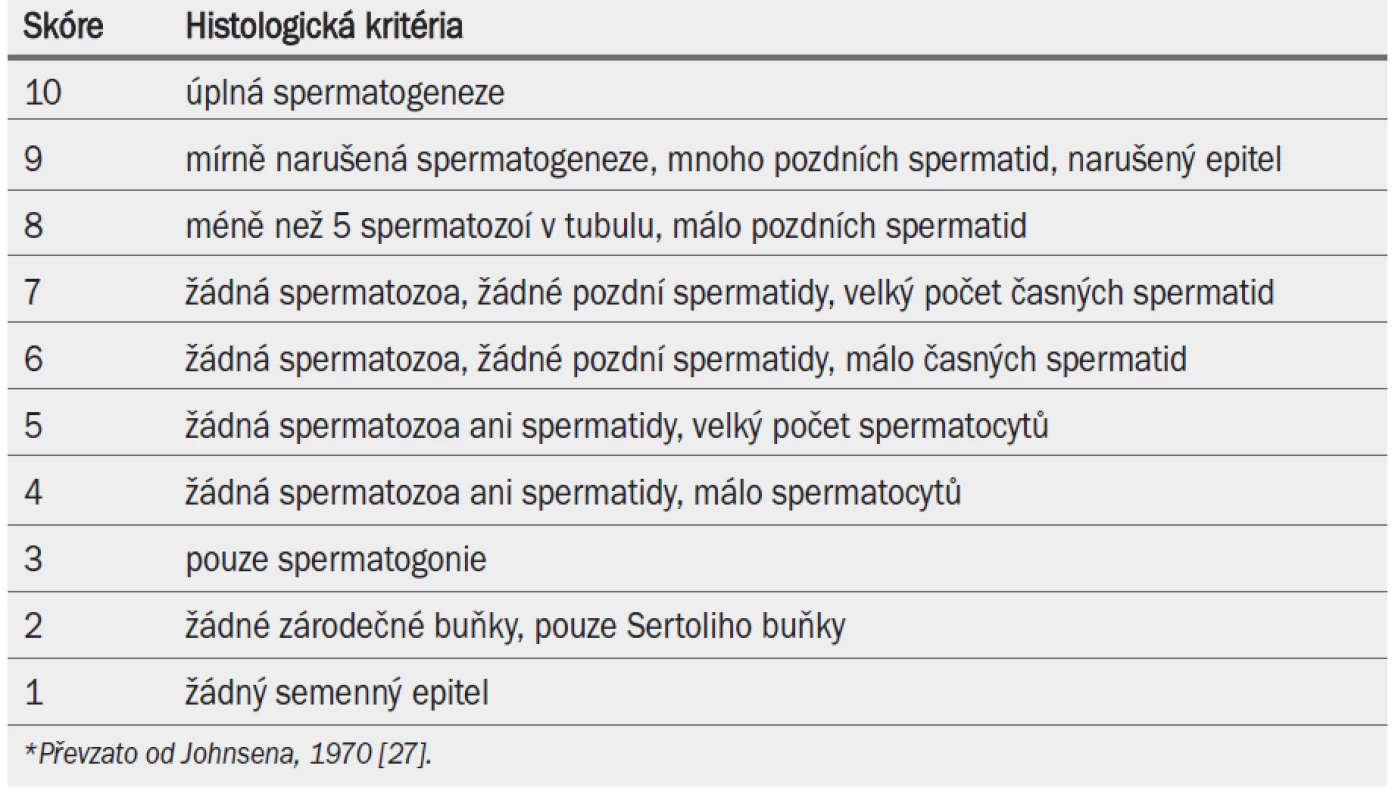
5.4 Léčba
5.4.1 Intratestikulární obstrukce
Rekanalizace semenných váčků není na této úrovni možná. Téměř u všech pacientů s OA je možné získat spermie pomocí testikulární extrakce spermií (TESE) nebo mikrochirurgické aspirace spermií z epididymis (MESA). Získaná spermatozoa lze okamžitě použít pro ICSI nebo je kryoprezervovat.
5.4.2 Obstrukce epididymis
Mikrochirurgická aspirace spermií z nadvarlete (MESA) [28] je indikována u mužů s CBAVD. Dalšími metodami pro odběr spermií z nadvarlete u mužů s OA jsou TESA a PESE [29]. Získaná spermatozoa jsou použita pro ICSI. Obvykle platí, že jedna procedura MESA poskytne dostatek materiálu pro několik cyklů ICSI [30] a dosahuje vysoké míry gravidity a fertilizace [31]. U pacientů s azoospermií, která je způsobena získanou obstrukcí epididymis, se doporučuje mikrochirurgická epididymovazostomie end-end nebo end--side. Nejlepší techniku představuje mikrochirurgická epididymovazostomie s intususcepcí [32].
Rekonstrukci lze provádět uni - či bilaterálně; míra průchodnosti a otěhotnění je obvykle vyšší po bilaterální rekonstrukci. Před provedením mikrochirurgického výkonu je důležité zkontrolovat volnou průchodnost od epididymis směrem distálně. Anatomická rekanalizace po operaci může trvat 3–18 měsíců. Před zákrokem (a také ve všech případech, kdy není rekanalizace možná) by měla být – pro případ selhání operace – z nadvarlete odsáta a kryoprezervována spermatozoa pro případné použití při ICSI [30].
Míra průchodnosti se pohybuje mezi 60 a 87 % [33–35] a kumulativní míra otěhotnění mezi 10 a 43 %. Na úspěšnost rekanalizace mohou mít negativní vliv předoperační a operační nálezy (např. průvodní abnormální testikulární histologie, absence spermií ve spermatické tekutině z malých tubulů nadvarlete a fibróza epididymis).
5.4.3 Obstrukce proximální části chámovodu
Obstrukce proximální části chámovodu po vazektomii vyžaduje mikrochirurgickou rekonstrukci (viz kap. 10 Mužská antikoncepce). Vazovazostomie je nutná ve vzácných případech obstrukce proximální části chámovodu (iatrogenní, posttraumatické, pozánětlivé). Pokud nejsou v tekutině získané při operaci chámovodu přítomna spermatozoa, je obvykle současně přítomna sekundární obstrukce epididymis zejména v případě, kdy má tekutina z proximální části chámovodu hutnou konzistenci připomínající zubní pastu. V tomto případě je indikována mikrochirurgická vazoepididymostomie.
5.4.4 Obstrukce distální části chámovodu
Rozsáhlé bilaterální defekty chámovodu způsobené nechtěnou excizí chámovodu během operace hernie v útlém dětství nebo dřívější orchidopexe většinou nelze vyléčit [16]. V těchto případech je možné provést aspiraci spermií z proximálního chámovodu [37] nebo TESE/MESA pro kryoprezervaci spermií, které lze později využít při ICSI. Při rozsáhlých jednostranných defektech chámovodu spojených s kontralaterální atrofií varlete je možné použít chámovod atrofovaného varlete pro zkříženou vazovazostomii nebo vazoepididymostomii.
5.4.5 Obstrukce ejakulačních kanálků
Léčba obstrukce ejakulačních kanálků závisí na etiologii této poruchy. U rozsáhlých pozánětlivých obstrukcí a v případě, kdy se jeden či oba ejakulační vývody vyprazdňují do intraprostatické střední cysty, se doporučuje transuretrální resekce ejakulačních vývodů (TURED) [20,38]. Resekcí je možno odstranit část verumontana. V případě obstrukce způsobené střední intraprostatickou cystou je nutná incize či odstranění klenby cysty [20]. Díky peroperační TRUS je tato metoda bezpečnější. Pokud chceme během této procedury vyšetřit distální část semenného ústrojí, může injekce metylenové modři do chámovodu pomoci zdokumentovat průchodnost vývodu. Je však nutné zvážit nízkou míru úspěšnosti operační léčby obstrukce ejakulačních kanálků (posuzováno podle počtu spontánních početí) oproti aspiraci spermií a ICSI.
Komplikace po TURED zahrnují retrográdní ejakulaci způsobenou poraněním hrdla močového měchýře, reflux moči do vývodů, semenných váčků a chámovodu (jež způsobují špatnou motilitu spermií, kyselé pH ejakulátu a epididymitidu). Alternativami k TURED jsou MESA, TESE, aspirace spermií z proximální části chámovodu, ultrazvukově naváděná aspirace ze semenných váčků a řízená aspirace z cyst. V případě funkční obstrukce distálních semenných váčků není často TURED při zlepšení produkce spermií účinná. Spermatozoa lze v tomto případě získat antegrádním proplachem semenného ústrojí [38]. Spermatozoa získaná kteroukoli výše uvedenou chirurgickou metodou by měla být vždy kryoprezervována pro účely asistované reprodukce.
5.5 Závěry a doporučení pro muže s obstrukční azoospermií
U pacientů s azoospermií či vážnou oligozoospermií s normální velikostí varlat a normálními endokrinními nálezy je třeba předpokládat přítomnost obstrukčních lézí semenných cest.
Výsledky rekonstrukční mikrochirurgické operace závisejí na příčině a lokalizaci obstrukce a na zkušenosti operatéra. Standardní procedury zahrnují vazovazostomii a epididymovazostomii.
Navíc lze indikovat extrakci spermií metodami MESA, TESE a PESE. Tyto metody by měly být voleny pouze v případě, že existuje možnost kryoprezervace získaného materiálu.
V případě azoospermie způsobené obstrukcí epididymis by měla být explorace skrota provedena současně s mikrochirurgickou aspirací spermií z epididymis a kryoprezervací spermatozoí a mikrochirurgickou rekonstrukcí [35] (stupeň doporučení: B).
6. Varikokéla
Zdroje
1. Hendry WF. Azoospermia and surgery for testicular obstruction. In: Hargreave TB (ed). Male Infertility. Berlin: Springer-Verlag 1997 : 319–336.
2. Hendry WF, Parslow JM, Stedronska J. Exploratory scrototomy in 168 azoospermic males. Br J Urol 1983; 55(6): 785–791. http://www.ncbi.nlm.nih.gov/pubmed/6652453.
3. Jequier AM. Obstructive azoospermia: a study of 102 patients. Clin Reprod Fertil 1985; 3(1): 21–36. http://www.ncbi.nlm.nih.gov/pubmed/3978535.
4. Pierik FH, Vreeburg JT, Stijnen T et al. Serum inhibin B as a marker of spermatogenesis. J Clin Endocrinol Metab 1998; 83(9): 3110–3114. http://www.ncbi.nlm.nih.gov/pubmed/9745412.
5. Oates RD, Amos JA. The genetic basis of congenital bilateral absence of the vas deferens and cystic fibrosis. J Androl 1994; 15(1): 1–8. http://www.ncbi.nlm. nih.gov/pubmed/8188533.
6. Handelsman DJ, Conway AJ, Boylan LM et al. Young’s syndrome: obstructive azoospermia and chronic sinopulmonary infections. New Engl J Med 1984; 310(1): 3–9. http://www.ncbi.nlm.nih.gov/pubmed/6689737.
7. Silber SJ, Grotjan HE. Microscopic vasectomy reversal 30 years later: a summary of 4010 cases by the same surgeon. J Androl 2004; 25(6): 845–859. http://www.ncbi.nlm.nih.gov/pubmed/15477352.
8. Schoysman R. Vaso-epididymostomy - a survey of techniques and results with considerations of delay of appearance of spermatozoa after surgery. Acta Eur Fertil 1990; 21(5): 239–245. http://www.ncbi.nlm.nih.gov/pubmed/2132475.
9. Matthews GJ, Schlegel PN, Goldstein M. Patency following microsurgical vasoepididymostomy and vasovasostomy: temporal considerations. J Urol 1995; 154(6): 2070–2073. http://www.ncbi.nlm.nih.gov/pubmed/7500460.
10. Jarvi K, Zini A, Buckspan MB et al. Adverse effects on vasoepididymostomy outcomes for men with concomitant abnormalities in the prostate and seminal vesicle. J Urol 1998; 160(4): 1410–1412. http://www.ncbi.nlm.nih.gov/pubmed/9751365.
11. Raleigh D, O’Donnell L, Southwick GJ et al. Stereological analysis of the human testis after vasectomy indicates impairment of spermatogenic efficiency with increasing obstructive interval. Fertil Steril 2004; 81(6): 1595–1603. http://www.ncbi.nlm.nih.gov/pubmed/15193483.
12. McVicar CM, O’Neill DA, McClure N et al. Effects of vasectomy on spermatogenesis and fertility outcome after testicular sperm extraction combined with ICSI. Hum Reprod 2005; 20(10): 2795–2800. http://www.ncbi.nlm.nih.gov/pubmed/15958397.
13. Sheynkin YR, Hendin BN, Schlegel PN et al. Microsurgical repair of iatrogenic injury to the vas deferens. J Urol 1998; 159(1): 139–141. http://www.ncbi.nlm.nih.gov/pubmed/9400456.
14. Shin D, Lipshultz LI, Goldstein M et al. Herniorrhaphy with polypropylene mesh causing inguinal vassal obstruction: a preventable cause of obstructive azoospermia. Ann Surg 2005; 241(4): 553–558. http://www.ncbi.nlm.nih.gov/pubmed/15798455.
15. Schlegel PN, Shin D, Goldstein M. Urogenital anomalies in men with congenital absence of the vas deferens. J Urol 1996; 155(5): 1644–1648. http://www.ncbi.nlm.nih.gov/pubmed/8627844.
16. Borovikov A. Treatment of large vasal defects. In: Goldstein M (ed). Surgery of Male Infertility. Philadelphia: WB Saunders 1995 : 77–95.
17. Elder JS, Mostwin JL. Cyst of the ejaculatory duct/urogenital sinus. J Urol 1984; 132(4): 768–771. http://www.ncbi.nlm.nih.gov/pubmed/6471229.
18. Schuhrke TD, Kaplan GW. Prostatic utricle cysts (müllerian duct cysts). J Urol 1978; 119(6): 765–767. http://www.ncbi.nlm.nih.gov/pubmed/26814.
19. Surya BV, Washecka R, Glasser J et al. Cysts of the seminal vesicles: diagnosis and management. Br J Urol 1988; 62(5): 491–493. http://www.ncbi.nlm.nih.gov/pubmed/3208033.
20. Schroeder-Printzen I, Ludwig M, Kohn F et al. Surgical therapy in infertile men with ejaculatory duct obstruction: technique and outcome of a standardized surgical approach. Hum Reprod 2000; 15(6): 1364–1368. http://www.ncbi.nlm.nih.gov/pubmed/10831570.
21. Kuligowska E, Baker CE, Oates RD. Male infertility: role of transrectal US in diagnosis and management. Radiology 1992; 185(2): 353–360. http://www.ncbi.nlm.nih.gov/pubmed/1410338.
22. Colpi GM, Casella F, Zanollo A et al. Functional voiding disturbances of the ampullo-vesicular seminal tract: a cause of male infertility. Acta Eur Fertil 1987; 18(3): 165–179. http://www.ncbi.nlm.nih.gov/pubmed/3125711.
23. Hendry WF, Rickards D, Pryor JP et al. Seminal megavesicles with adult polycystic kidney disease. Hum Reprod 1998; 13(6): 1567–1569. http://www.ncbi.nlm.nih.gov/pubmed/9688393.
24. Colpi GM, Negri L, Nappi RE et al. Is transrectal ultrasonography a reliable diagnostic approach in ejaculatory duct sub-obstruction? Hum Reprod 1997; 12(10): 2186–2191. http://www.ncbi.nlm.nih.gov/pubmed/9402280.
25. Meacham RB, Hellerstein DK, Lipshultz LI. Evaluation and treatment of ejaculatory duct obstruction in the infertile male. Fertil Steril 1993; 59(2): 393–397. http://www.ncbi.nlm.nih.gov/pubmed/8709296.
27. Johnsen SG. Testicular biopsy score count-a method for registration of spermatogenesis in human testes: normal values and results in 335 hypogonadal males. Hormones 1970; 1(1): 2–25. http://www.ncbi.nlm.nih.gov/pubmed/5527187.
28. Silber SJ, Balmaceda J, Borrero C et al. Pregnancy with sperm aspiration from the proximal head of the epididymis: a new treatment for congenital absence of the vas deferens. Fertil Steril 1988; 50(3): 525–528. http://www.ncbi.nlm.nih.gov/pubmed/3410105.
29. Esteves SC, Miyaoka R, Agarwal A. Sperm retrieval techniques for assisted reproduction. Int Braz J Urol 2011; 37(5): 570–583. http://www.ncbi.nlm.nih.gov/pubmed/22099268.
30. Schroeder-Printzen I, Zumbe G, Bispink L et al. Microsurgical epididymal sperm aspiration: aspirate analysis and straws available after cryopreservation in patients with non-reconstructable obstructive azoospermia. MESA/TESE Group Giessen. Hum Reprod 2000; 15(12): 2531–2535. http://www.ncbi.nlm.nih.gov/pubmed/11098022.
31. Van Peperstraten A, Proctor ML, Johnson NP et al. Techniques for surgical retrieval of sperm prior to ICSI for azoospermia. Cochrane Database Syst Rev 2006; 3: CD002807. http://www.mrw.interscience.wiley.com/cochrane/clsysrev/articles/CD002807/frame.html.
32. Chan PT, Brandell RA, Goldstein M. Prospective analysis of outcomes after microsurgical intussusception vasoepididymostomy. BJU Int 2005; 96(4): 598-601. http://www.ncbi.nlm.nih.gov/pubmed/16104917.
33. Matthews GJ, Schlegel PN, Goldstein M. Patency following microsurgical vasoepididymostomy and vasovasostomy: temporal consideration. J Urol 1995; 154(6): 2070–2073. http://www.ncbi.nlm.nih.gov/pubmed/7500460.
34. Mangoli V, Dandekar S, Desai S et al. The outcome of ART in males with impaired spermatogenesis. Hum Reprod Sci 2008; 1(2): 73–76. http://www.ncbi.nlm.nih.gov/pubmed/19562049.
35. Kim ED, Winkel E, Orejuela F et al. Pathological epididymal obstruction unrelated to vasectomy: results with microsurgical reconstruction. J Urol 1998; 160 (6 Pt 1): 2078–2080. http://www.ncbi.nlm.nih.gov/pubmed/9817328.
36. Kolettis PN, Thomas AJ Jr. Vasoepididymostomy for vasectomy reversal: a critical assessment in the era of intracytoplasmic sperm injection. J Urol 1997; 158(2): 467–470. http://www.ncbi.nlm.nih.gov/pubmed/9224325.
37. Ruiz-Romero J, Sarquella J, Pomerol JM. A new device for microsurgical sperm aspiration. Andrologia 1994; 26(2): 119–120. http://www.ncbi.nlm.nih.gov/pubmed/8042769.
38. Fisch H, Lambert SM, Goluboff ET. Management of ejaculatory duct obstruction: etiology, diagnosis, and treatment. World J Urol 2006; 24(6): 604–610. http://www.ncbi.nlm.nih.gov/pubmed/17077974.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2012 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Vedlejší účinky hormonální substituční léčby testosteronem
- Vývoj chirurgického odběru spermií u mužů s azoospermií
- Adenomatoidní tumor varlete – diagnostika a doporučené operační postupy
- Vaporizace prostaty pomocí zeleného laseru (GreenLight laser) – zkušenost z jednoho centra po provedení více než 1 000 výkonů
- Syntetický miduretrální sling při léčbě močové inkontinence u žen: analýza 1 000 případů z jednoho centra
- Slovo úvodem
- Virulentný profil a rezistencia Escherichia coli izolovaných od imunokompromitovaných pacientov pri urosepse
- Sekvence léčby a sledování pacienta s metastatickým kastračně rezistentním karcinomem prostaty
-
Guidelines EAU pro léčbu mužské infertility
1. Metodologie -
Guidelines EAU pro léčbu mužské infertility
2. Vyšetření -
Guidelines EAU pro léčbu mužské infertility
3. Testikulární nedostatečnost (selhání spermatogeneze) -
Guidelines EAU pro léčbu mužské infertility
4. Genetické poruchy u infertilních mužů -
Guidelines EAU pro léčbu mužské infertility
5. Obstrukční azoospermie - Nádory penisu spojené s výskytem dalších novotvarů
-
Guidelines EAU pro léčbu mužské infertility
6. Varikokéla -
Guidelines EAU pro léčbu mužské infertility
7. Hypogonadizmus -
Guidelines EAU pro léčbu mužské infertility
8. Kryptorchizmus -
Guidelines EAU pro léčbu mužské infertility
9. Idiopatická mužská infertilita -
Guidelines EAU pro léčbu mužské infertility
10. Mužská antikoncepce -
Guidelines EAU pro léčbu mužské infertility
11. Infekce mužských přídatných žláz -
Guidelines EAU pro léčbu mužské infertility
12. Maligní onemocnění ze zárodečných buněk a testikulární mikrokalcifikace -
Guidelines EAU pro léčbu mužské infertility
13. Poruchy ejakulace -
Guidelines EAU pro léčbu mužské infertility
14. Kryoprezervace ejakulátu -
Guidelines EAU pro léčbu mužské infertility
15. Zkratky užité v textu
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vedlejší účinky hormonální substituční léčby testosteronem
- Adenomatoidní tumor varlete – diagnostika a doporučené operační postupy
-
Guidelines EAU pro léčbu mužské infertility
13. Poruchy ejakulace -
Guidelines EAU pro léčbu mužské infertility
5. Obstrukční azoospermie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



