-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Guidelines EAU pro léčbu mužské infertility
3. Testikulární nedostatečnost (selhání spermatogeneze)
Autoři: A. Jungwirth; T. Diemer; G. R. Dohle; A. Giwercman; Z. Kopa; C. Krausz; H. Tournaye
Vyšlo v časopise: Urol List 2012; 10(4): 50-52
Kategorie: Guidelines
© European Association of Urology 2012
2. Vyšetření
3. Testikulární nedostatečnost (selhání spermatogeneze)
3.1 Definice
Testikulární nedostatečnost jako důsledek selhání spermatogeneze je způsobená jinou příčinou než hypotalamo-hypofyzárním onemocněním a obstrukcí mužského genitálního traktu. Jedná se o nejčastější formu snížené mužské fertility. Testikulární nedostatečnost může mít rozličné příčiny, klinicky se však prezentuje jako závažná OAT nebo neobstrukční azoospermie (NOA) [1].
3.2 Příčina vzniku
Příčiny vzniku testikulární nedostatečnosti jsou shrnuty v tab. 5.
Tab. 1. Příčiny testikulární nedostatečnosti. 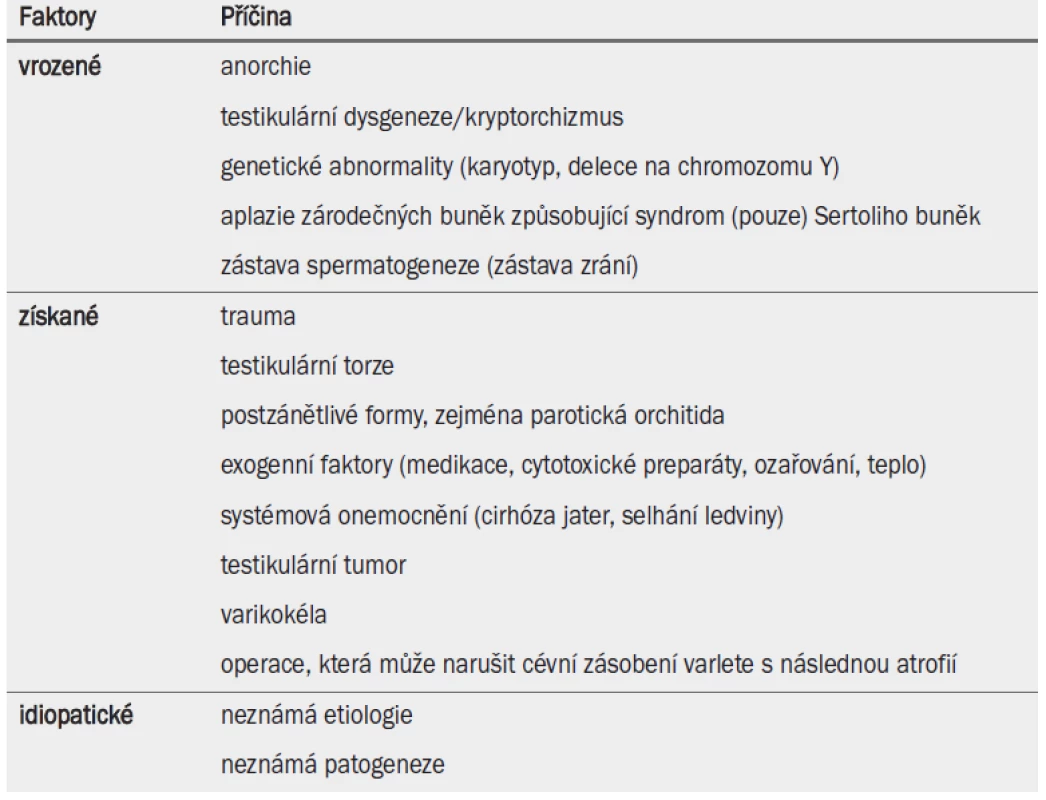
3.3 Lékařská anamnéza a fyzikální vyšetření
Typická zjištění lékařské anamnézy a fyzikálního vyšetření u pacientů s testikulární insuficiencí zahrnují:
- kryptorchizmus
- testikulární torze
- infekce močopohlavních cest
- testikulární trauma
- vystavení toxickým látkám v prostředí
- gonadotoxická farmakoterapie
- ozařování nebo vystavení chemickým látkám
- testikulární karcinom
- absence varlat
- abnormální charakteristika sekundárních pohlavních znaků
- gynekomastie
- abnormální testikulární objem a/nebo konzistence
- varikokéla
3.4 Vyšetření
Běžné vyšetření zahrnuje analýzu ejakulátu a stanovení hormonálních hladin. Další vyšetření jsou indikována na základě individuálních okolností.
3.4.1 Analýza ejakulátu
U NOA prokazuje analýza ejakulátu po odstředění normální objem ejakulátu a azoospermii. Doporučuje se odstředění ejakulátu při 3 000 g po dobu 15 min a důkladné mikroskopické vyšetření pelet pomocí optického systému fázového kontrastu při 200násobném zvětšení. Všechny vzorky lze nabarvit a znovu vyšetřit pod mikroskopem [2].
3.4.2 Stanovení hormonálních hladin
U mužů s testikulární nedostatečností je obvykle přítomen hypergonadotropní hypogonadizmus, vysoká hladina folikuly stimulujícího hormonu (FSH) i luteinizačního hormonu (LH) a v některých případech nižší hladina testosteronu.
Hladina folikuly stimulujícího hormonu (FSH) obvykle koreluje zejména s počtem spermatogonií:
- v případě, že tyto buňky chybějí nebo je jejich počet výrazně nižší, bývá hodnota FSH obvykle zvýšená
- v případě normálního počtu spermatogonií, ale úplné blokády spermatocytů nebo spermatid, se hladina FSH pohybuje v normálním rozmezí.
U jednotlivých pacientů však hladina FSH neumožňuje přesně předvídat stav spermatogeneze [3–5]. Předběžné údaje ukazují na užší souvislost mezi nižší hladinou inhibinu B a poškozením spermatogeneze [6].
3.4.3 Biopsie varlete
Testikulární biopsii lze provádět jako součást léčby u pacientů s klinicky prokázanou NOA, kteří se rozhodli podstoupit intracytoplazmatickou injekci spermie (ICSI). Technikou volby je extrakce spermií z varlete (TESE), která dosahuje vynikajících výsledků i při opakovaném provádění [7–9]. Spermatogeneze může být fokální, což znamená, že přibližně u 50–60 % mužů s NOA lze odebrat spermatozoa, která lze využít pro ICSI. Většina autorů proto doporučuje odebrání několika vzorků biopsie varlete [10,11].
Existuje úzká spojitost mezi histologickým vyšetřením vzorku z diagnostické biopsie a pravděpodobností nálezu zralých spermatických buněk během odběruspermií a ICSI [12,13]. Mezi hladinou FSH, inhibinu B, testikulárním objemem a úspěšným odběrem spermií však nebyla zjištěna žádná souvislost. V případě mikrodelecí v oblastech AZFa a AZFb je pravděpodobnost získání spermatozoí prakticky nulová.
Mikrochirurgická extrakce spermií (TESE) může zvýšit šanci na získání spermií, k dispozici však zatím nemáme žádné komparativní studie [14–16]. Po otevření varlete jsou kanálky o větším průměru excidovány pomocí mikronůžek. Kanálky jsou následně pomocí mechanické nebo enzymatické digesce rozmělněny, což usnadní hledání spermií [17]. Pozitivní výsledky byly zaznamenány dokonce u syndromu ze Sertoliho buněk II. typu [14]. Perkutánní aspirace spermií z epididymis (PESA) je spojena s nižší mírou získání spermií a neumožňuje provedení histologického vyšetření pro detekci karcinomu in situ (CIS) a maligních onemocnění ve varleti [18,19]. PESA může navíc způsobit větší tubulární a vaskulární poškození než TESE [20].
Výsledky ICSI jsou horší u mužů s NOA po extrakci spermií než u mužů, u nichž byly spermie získány přímo z ejakulátu a mužů s obstrukční azoospermií (OA) [21–24].
- míra početí je nižší u mužů s NOA než u mužů s OA (19 vs 28 %) [25]
- míra fertilizace a implantace je signifikantně nižší [26]
- míra potratovosti je vyšší u mužů s NOA než u mužů s OA (11,5 vs 2,5 %) [27]
U mužů s OA nebyl při ICSI zjištěn signifikantní rozdíl mezi získáváním spermií z varlat nebo epididymis [24] ani mezi užíváním čerstvých a zmražených-rozmražených spermií [22,26–28].
3.5 Závěry a doporučení pro pacienty trpící testikulární insuficiencí
Narušená spermatogeneze je často spojena se zvýšenou koncentrací FSH.
Nejlepší metodou pro stanovení histologické diagnózy a získání spermií je testikulární biopsie. V případě, že jsou identifikována spermatozoa, mohou být kryoprezervována pro budoucí užití při ICSI.
Spermatozoa jsou přítomna přibližně u 60 % pacientů s neobstrukční azoospermií (NOA).
Kandidátům pro odběr spermií je nezbytné poskytnout informace týkající se genetických faktorů.
Pro pacienty s NOA, u nichž jsou při testikulární biopsii přítomna spermatozoa, je jedinou terapeutickou možností ICSI s užitím čerstvých nebo kryoprezervovaných spermatozoí.
U 30–50 % párů s NOA, u nichž byla při testikulární biopsii přítomna spermatozoa, je dosaženo gravidity a početí zdravého potomka.
Mužům s neobstrukční azoospermií (NOA) lze nabídnout testikulární extrakci spermií a kryoprezervaci spermatozoí pro pozdější využití při intracytoplazmatické injekci spermií [28] (stupeň doporučení: B).
V zájmu zvýšení šance na získání spermií u mužů s neobstrukční azoospermií se namísto PESA doporučuje spíše testikulární extrakce spermií (jednorázová, vícečetná nebo mikrochirurgická) (stupeň doporučení: B).
4. Genetické poruchy u infertilních mužů
Zdroje
1. World Health Organization. WHO Manual for the Standardised Investigation, Diagnosis and Management of the Infertile Male. Cambridge: Cambridge University Press, 2000.
2. World Health Organization. WHO Laboratory Manual for the Examination and Processing of Human Semen. 5th ed. WHO, 2010. http://www.who.int/reproductivehealth/publications/infertility/9789241547789/en/index.html
3. Hauser R, Temple-Smith PD, Southwick GJ, et al. Fertility in cases of hypergonadotropic azoospermia. Fertil Steril 1995; 63(3): 631–636. http://www.ncbi.nlm.nih.gov/pubmed/7851598.
4. Martin-du Pan RC, Bischof P. Increased follicle stimulating hormone in infertile men. Is increased plasma FSH always due to damaged germinal epithelium? Hum Reprod 1995; 10(8): 1940–1945. http://www.ncbi.nlm.nih.gov/pubmed/8567817
5. De Kretser DM, Burger HG, Hudson B. The relationship between germinal cells and serum FSH in males with infertility. J Clin Endocrinol Metab 1974; 38(5): 787–793. http://www.ncbi.nlm.nih.gov/pubmed/4823921.
6. Pierik FH, Vreeburg JT, Stijnen T et al. Serum inhibin B as a marker of spermatogenesis. J Clin Endocrinol Metab 1998; 83(9): 3110–31114. http://www.ncbi.nlm.nih.gov/pubmed/9745412.
7. Amer M, Haggar SE, Moustafa T et al. Testicular sperm extraction: impact to testicular histology on outcome, number of biopsies to be performed and optional time for repetition. Hum Reprod 1999; 14(12): 3030–3034. http://www.ncbi.nlm.nih.gov/pubmed/10601092.
8. Colpi GM, Piediferro G, Nerva F et al. Sperm retrieval for intra-cytoplasmic sperm injection in nonobstructive azoospermia. Minerva Urol Nefrol 2005; 57(2): 99–107. http://www.ncbi.nlm.nih.gov/pubmed/15951734.
9. Vernaeve V, Verheyen G, Goossens A et al. How successful is repeat testicular sperm extraction in patients with azoospermia? Hum Reprod 2006; 21(6): 1551–1554. http://www.ncbi.nlm.nih.gov/pubmed/16473930.
10. Gottschalk-Sabag S, Weiss DB, Folb-Zacharow N et al. Is one testicular specimen sufficient for quantitative evaluation of spermatogenesis? Fertil Steril 1995; 64(2): 399–402. http://www.ncbi.nlm.nih.gov/pubmed/7615120.
11. Turek PJ, Cha I, Ljung BM. Systematic fine-needle aspiration of the testis: correlation to biopsy and results of organ ‘mapping’ for mature sperm in azoospermic men. Urology 1997; 49(5): 743–748. http://www.ncbi.nlm.nih.gov/pubmed/9145981.
12. Abdel-Meguid TA. Predictors of sperm recovery and azoospermia relapse in men with nonobstructive azoospermia after varicocele repair. J Urol 2012; 187(1): 222–226. http://www.ncbi.nlm.nih.gov/pubmed/22100001.
13. Kim ED, Gilbaugh JH 3rd, Patel VR, et al. Testis biopsies frequently demonstrate sperm in men with azoospermia and significantly elevated follicle-stimulating hormone levels. J Urol 1997; 157(1): 144–146. http://www.ncbi.nlm.nih.gov/pubmed/8976237.
14. Colpi GM, Piediferro G, Nerva F et al. Sperm retrieval for intra-cytoplasmic sperm injection in nonobstructive azoospermia. Minerva Urol Nefrol 2005; 57(2): 99–107. http://www.ncbi.nlm.nih.gov/pubmed/15951734.
15. Schlegel PN. Testicular sperm extraction: microdissection improves sperm yield with minimal tissue excision. Hum Reprod 1999; 14(1): 131–135. http://www.ncbi.nlm.nih.gov/pubmed/10374109.
16. Okada H, Dobashi M, Yamazaki T et al. Conventio nal versus microdissection testicular sperm extraction for non obstructive azoospermia. J Urol 2002; 168(3): 1063–1067. http://www.ncbi.nlm.nih.gov/pubmed/12187223.
17. Esteves SC, Miyaoka R, Agarwal A. Sperm retrieval techniques for assisted reproduction. Int Braz J Urol 2011; 37(5): 570–583. http://www.ncbi.nlm.nih.gov/pubmed/22099268.
18. Monzo A, Kondylis F, Lynch D et al. Outcome of intracytoplasmic sperm injection in azoospermic patients: stressing the liaison between the urologist and reproductive medicine specialist. Urology 2001; 58(1): 69–75. http://www.ncbi.nlm.nih.gov/pubmed/11445482.
19. Vernaeve V, Tournaye H, Osmanagaoglu K et al. Intracytoplasmic sperm injection with esticular spermatozoa is less successful in men with nonobstructive azoospermia than in men with obstructive azoospermia. Fertil Steril 2003; 79(3): 529–533. http://www.ncbi.nlm.nih.gov/pubmed/12620435.
20. Silber S, Munne S. Chromosomal abnormalities in embryos derived from testicular sperm extraction tese) in men with non-obstructive azoospermia. In: Proceedings of EAA International Symposium. Genetics of male infertility: from research to clinic. October 2-4, 2003, Florence, Italy.
21. Schwarzer J, Fiedler K, Hertwig I et al. Sperm retrieval procedures and intracytoplasmatic spermatozoa injection with epididymal and testicular sperms. Urol Int 2003; 70(2): 119–123. http://www.ncbi.nlm.nih.gov/pubmed/12592040.
22. Ghanem M, Bakr NI, Elgayaar MA et al. Comparison of the outcome of intracytoplasmic sperm injection in obstructive and non-obstructive azoospermia in the first cycle: a report of case series and meta-analysis. Int J Androl 2005; 28(1): 16–21. http://www.ncbi.nlm.nih.gov/pubmed/15679616.
23. Borges E Jr, Rossi-Ferragut LM, Pasqualotto FF, et al. Testicular sperm results in elevated miscarriage rates compared to epididymal sperm in azoospermic patients. Sao Paulo Med J 2002; 120(4): 122–126. http://www.ncbi.nlm.nih.gov/pubmed/12436160.
24. Gil Salom M. Spermatic recovery techniques for intracytoplasmic spermatozoid injection (ICSI) in male infertility. Arch Esp Urol 2004; 57(9): 1035–1046. [Article in Spanish] http://www.ncbi.nlm.nih.gov/pubmed/15624403.
25. Ben-Yosef D, Yogev L, Hauser R, et al. Testicular sperm retrieval and cryopreservation prior to initiating ovarian stimulation as the first line approach in patients with non-obstructive azoospermia. Hum Reprod 1999; 14(7): 1794–1801. http://www.ncbi.nlm.nih.gov/pubmed/10402392.
26. Gil-Salom M, Romero J, Rubio C, et al. Intracytoplasmic sperm injection with cryopreserved testicular spermatozoa. Mol Cell Endocrinol 2000; 169(1–2): 15–19. http://www.ncbi.nlm.nih.gov/pubmed/11155947.
27. Sousa M, Cremades N, Silva J et al. Predictive value of testicular histology in secretory azoospermic subgroups and clinical outcomes after microinjection of fresh and frozen-thawed sperm and spermatids. Hum Reprod 2002; 17(7): 1800–1810. http://www.ncbi.nlm.nih.gov/pubmed/12093843.
28. Hauser R, Yogev L, Amit A et al. Severe hypospermatogenesis in cases of nonobstructive azoospermia: should we use fresh or frozen testicular spermatozoa? J Androl 2005; 26(6): 772–778. http://www.ncbi.nlm.nih.gov/pubmed/16291973.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2012 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Vedlejší účinky hormonální substituční léčby testosteronem
- Vývoj chirurgického odběru spermií u mužů s azoospermií
- Adenomatoidní tumor varlete – diagnostika a doporučené operační postupy
- Vaporizace prostaty pomocí zeleného laseru (GreenLight laser) – zkušenost z jednoho centra po provedení více než 1 000 výkonů
- Syntetický miduretrální sling při léčbě močové inkontinence u žen: analýza 1 000 případů z jednoho centra
- Slovo úvodem
- Virulentný profil a rezistencia Escherichia coli izolovaných od imunokompromitovaných pacientov pri urosepse
- Sekvence léčby a sledování pacienta s metastatickým kastračně rezistentním karcinomem prostaty
-
Guidelines EAU pro léčbu mužské infertility
1. Metodologie -
Guidelines EAU pro léčbu mužské infertility
2. Vyšetření -
Guidelines EAU pro léčbu mužské infertility
3. Testikulární nedostatečnost (selhání spermatogeneze) -
Guidelines EAU pro léčbu mužské infertility
4. Genetické poruchy u infertilních mužů -
Guidelines EAU pro léčbu mužské infertility
5. Obstrukční azoospermie - Nádory penisu spojené s výskytem dalších novotvarů
-
Guidelines EAU pro léčbu mužské infertility
6. Varikokéla -
Guidelines EAU pro léčbu mužské infertility
7. Hypogonadizmus -
Guidelines EAU pro léčbu mužské infertility
8. Kryptorchizmus -
Guidelines EAU pro léčbu mužské infertility
9. Idiopatická mužská infertilita -
Guidelines EAU pro léčbu mužské infertility
10. Mužská antikoncepce -
Guidelines EAU pro léčbu mužské infertility
11. Infekce mužských přídatných žláz -
Guidelines EAU pro léčbu mužské infertility
12. Maligní onemocnění ze zárodečných buněk a testikulární mikrokalcifikace -
Guidelines EAU pro léčbu mužské infertility
13. Poruchy ejakulace -
Guidelines EAU pro léčbu mužské infertility
14. Kryoprezervace ejakulátu -
Guidelines EAU pro léčbu mužské infertility
15. Zkratky užité v textu
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vedlejší účinky hormonální substituční léčby testosteronem
- Adenomatoidní tumor varlete – diagnostika a doporučené operační postupy
-
Guidelines EAU pro léčbu mužské infertility
13. Poruchy ejakulace -
Guidelines EAU pro léčbu mužské infertility
5. Obstrukční azoospermie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



