-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaGuidelines EAU pro léčbu mužské infertility
11. Infekce mužských přídatných žláz
Autoři: A. Jungwirth; T. Diemer; G. R. Dohle; A. Giwercman; Z. Kopa; C. Krausz; H. Tournaye
Vyšlo v časopise: Urol List 2012; 10(4): 71-76
Kategorie: Guidelines
© European Association of Urology 2012
10. Mužská antikoncepce
11. Infekce mužských přídatných žláz
11.1 Úvod
Infekce mužského močopohlavního systému představují potenciálně vyléčitelné příčiny mužské infertility [1–3]. Podle klasifikace WHO jsou uretritida, prostatitida, orchitida a epididymitida považovány za infekce mužských přídatných žláz (MAGI) [2]. Bohužel však neexistují konkrétní údaje, které by prokázaly negativní vliv těchto onemocnění na kvalitu spermií a obecně na mužskou fertilitu.
11.2 Uretritida
Infekční, sexuálním přenosem získaná uretritida může být způsobena mnoha patogeny, nejčastěji se jedná o Chlamydia trachomatis, Ureaplasma urealyticum a Neisseria gonorrhoea [4].
Neinfekční příčiny uretritidy zahrnují podráždění způsobené alergickými reakcemi, traumatem a manipulací. Výtok z močové trubice a mikční obtíže jsou predominantními symptomy akutní uretritidy.
11.2.1 Diagnostika a léčba
Diagnóza vychází z analýzy stěru z uretry a prvního proudu moči (VB1). Za patognomický je považován nález > 4 granulocytů na políčko hodnocené mikroskopem (1 000×) ve stěru z uretry nebo 15 granulocytů na mikroskopické políčko (400 ×) ve stěru sedimentu 3 ml VB1 [4]. V případě uretritidy provázené zánětlivým výtokem není možné provést analýzu ejakulátu, jež by umožnila detekovat poruchu fertility, neboť přední uretra obsahuje infekční a zánětlivý materiál, který brání spolehlivému rozboru [5].
Vzhledem k tomu, že je ejakulát kontaminován zánětlivým materiálem z uretry, nebyl prokázán vliv uretritidy na jeho kvalitu a fertilitu. Negativní vliv sexuálně přenosných mikroorganizmů na funkci spermií je stále předmětem debaty [1,6,7]. Mužskou fertilitu může dále negativně ovlivňovat přítomnost striktury močové trubice, poruchy ejakulace [2] a obstrukce [8]. Obstrukce se může manifestovat v podobě normální uretrální zúženiny nebo léze zadní uretry v oblasti verumontana; obojí může vést k poruchám ejakulace a centrální obstrukci semenných cest [2].
Léčba sexuálně přenosných chorob byla standardizována na základě guidelines Centra pro kontrolu a prevenci chorob v Atlantě (GA, USA) [9]. Vzhledem k tomu, že v době diagnózy není příčina vzniku akutní uretritidy ve většině případů známa, doporučuje se empirická terapie zaměřená na potenciální patogeny, která zahrnuje aplikaci jedné dávky fluorochinolonu a následnou dvoutýdenní léčbou doxycyklinem. Léčba je účinná nejen u gonokokových, ale i u (současně se vyskytujících) chlamydiových/ureaplazmatických infekcí.
11.3 Prostatitida
Prostatitida představuje nejčastější urologickou diagnózu u mužů mladších 50 let [10]. Obvykle se prostatitida dále dělí na čtyři formy:
- akutní bakteriální prostatitida (ABP) a prostatický absces jako následek/ /komplikace ABP
- chronická bakteriální prostatitida (CBP)
- nebakteriální (nebo abakteriální) prostatitida (NBP)
- prostatodynie
Národní institut zdraví (NIH) a Národní institut pro diabetes, nemoci zažívacího traktu a onemocnění ledvin (NIDDK) navrhly nový klasifikační systém pro zlepšení definice a porozumění syndromu prostatitidy [10] (tab. 12).
Tab. 1. NIH/NIDDK klasifikace syndromu prostatitidy.* 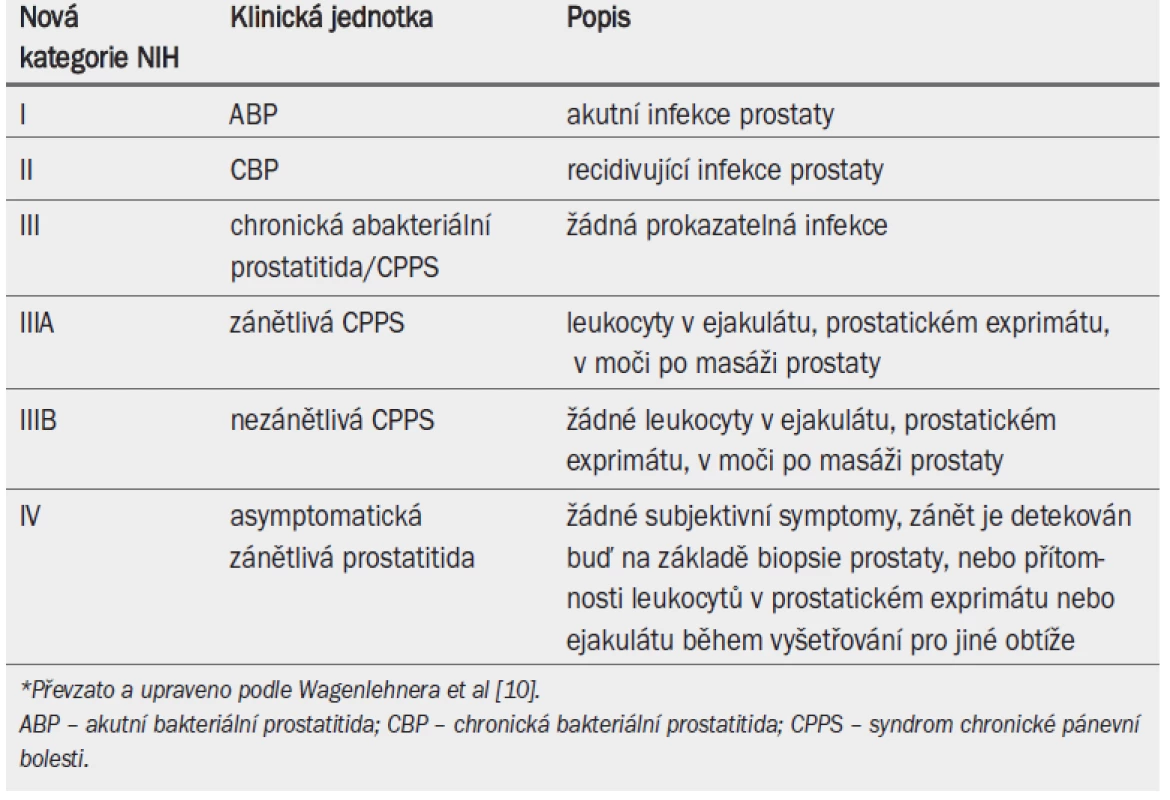
11.3.1 Mikrobiologie
Akutní bakteriální prostatitida (NIH I), CBP (NIH II) a zejména abscesy prostaty jsou klinicky významná, ale málo častá onemocnění. Nejčastější příčinou vzniku bakteriální prostatitidy jsou gramnegativní bakterie, zejména kmeny Escherichia coli [11]. Role grampozitivních bakterií u bakteriální prostatitidy není zcela jasná. Zatímco enterokoky mohou způsobovat bakteriální prostatitidu a s ní spojenou recidivující infekci močového ústrojí (UTI), význam ostatních grampozitivních bakterií u chronické prostatitidy, jako např. Ch. trachomatis a mykoplazma, zejména U. urealyticum [11–15], je rozporuplný [11]. Skryté bakterie se mohou etiologicky podílet na infekci u pacientů s chronickou idiopatickou prostatitidou po vyloučení typických bakteriálních infekcí [16]. Význam detekce bakterií pomocí molekulárních technik nebyl ještě s konečnou platností posouzen.
11.3.2 Diagnostika
Symptomy je třeba hodnotit pomocí standardizovaných skóre, zejména pomocí symptom skóre NIH (National Institutes of Health) [17]. Další metody zahrnují laboratorní diagnostiku CBP za použití čtyřvzorkového testu k lokalizaci bakterií [10,11], pomocí něhož se měří sekvenční kvantitativní bakteriologická kultivace z uretry, moči z močového měchýře a prostatického sekretu v prostatickém exprimátu (EPS) a moči po masáži prostaty [12]. Zjednodušené techniky srovnávají počet bakterií a leukocytů v moči před masáží prostaty a po ní [18]. Dále je třeba sledovat vyprazdňování močového měchýře a provést zobrazovací vyšetření prostatické žlázy. Základním nálezem pro diagnostikování prostatitidy je přítomnost leukocytů v EPS, moči po masáži prostaty a/nebo ejakulátu, jenž umožní odlišit zánětlivou a nezánětlivou CPPS.
11.3.3 Analýza ejakulátu
Analýza ejakulátu (viz kap. 2 Vyšetřování) pomáhá stanovit, zda je prostata postižena generalizovanou infekcí mužských přídatných pohlavních žláz a navíc poskytne informaci o kvalitě spermatu. Analýza leukocytů navíc umožní rozlišit mezi zánětlivou a nezánětlivou formou CPPS (NIH IIa vs NIH IIIb).
11.3.4 Mikrobiologické nálezy
Po vyloučení uretritidy a infekce močového měchýře svědčí přítomnost > 106 na peroxidázu pozitivních leukocytů na 1 ml ejakulátu o zánětlivém procesu. V tomto případě by měla být provedena kultivace na přítomnost obvyklých patogenů v močovém systému, zejména gramnegativních bakterií. Koncentrace > 103 cfu/ml patogenů z močového ústrojí v ejakulátu je považována za významnou bakteriospermii. Obvykle jsou u mužů na pracovištích zabývajících se infertilitou kultivovány různé mikroorganizmy, ve většině případů s více než jedním kmenem bakterií [1]. Čas odebírání vzorků může ovlivnit pozitivní počet mikroorganizmů v ejakulátu a frekvenci izolace různých kmenů [19].
Dosud nebyl vyvinut diagnostický test umožňující prokázat přítomnost Ch. trachomatis v ejakulátu [14]. V porovnání se sérologickými nálezy u žen nejsou protilátkové testy na Ch. trachomatis v semenné tekutině průkazné, pokud nejsou použity žádné typově specifické metody [14]. Ureaplasma urealyticum je patogenní pouze ve vysokých koncentracích (> 103 cfu/ml ejakulátu). Tento počet nepřekročilo jen 10 % vzorků analyzovaných na ureaplazmata [20]. Normální kolonizace uretry znesnadňuje při použití vzorků, jako je například ejakulát, nezbytné určení urogenitálních infekcí vyvolaných mykoplazmaty [15].
11.3.5 Leukocyty
Klinický význam zvýšené koncentrace leukocytů v ejakulátu je velmi sporný [21]. Obecně se za indikátor infekce považuje pouze zvýšený počet leukocytů (zvláště polymorfonukleárních leukocytů) a jejich produktů v semenné tekutině (např. leukocytová elastáza). Velká většina leukocytů jsou neutrofilní granulocyty podle specifického barvení peroxidázovou reakcí [2]. Přestože leukocytospermii lze považovat za znak zánětu, nemusí být nezbytně spojena s bakteriální nebo virovou infekcí [7]. Z dřívějších nálezů vyplývá, že zvýšený počet leukocytů není přirozenou příčinou mužské neplodnosti [22]. Podle klasifikace WHO je leukocytospermie definována jako > 106 leukocytů/ml. Pouze dvě studie analyzovaly změny leukocytů v ejakulátu u pacientů s prokázanou prostatitidou [23,24]. Obě prokázaly vyšší počet leukocytů než u mužů bez zánětu (CPPS, NIH typ IIIB).
11.3.6 Kvalita spermií
Nepříznivé účinky chronické prostatitidy na hustotu, pohyblivost a morfologii spermií jsou v současné době předmětem diskuze [1]. Všechny dosavadní studie uvádějí rozporuplné výsledky a nepotvrzují, že by chronická prostatitida měla klíčový vliv na změnu běžných parametrů ejakulátu [25–27].
11.3.7 Alterace semenné tekutiny
Elastáza v semenné tekutině slouží jako biochemický indikátor aktivity polymorfonukleárních lymfocytů v ejakulátu [1,28,29], doporučená hranice je asi 600 ng/ml [1]. Na zánětu se podílejí různé cytokiny, které mohou ovlivnit funkci spermií. Několik studií zkoumá spojitost mezi koncentrací interleukinu (IL), leukocyty a funkcí spermií [30–32], nebyla však prokázána žádná korelace.
Prostata je hlavním místem vzniku interleukinu-6 (IL-6) v semenné tekutině. Cytokiny, zejména IL-6, hrají významnou roli při zánětlivých procesech mužských přídatných žláz [33]. Zvýšená hladina cytokinů však nesouvisí s počtem leukocytů v EPS [34].
11.3.8 Žlázové sekreční dysfunkce
Infekce pohlavních orgánů může vést k narušení jejich sekreční funkce. Pokles hodnot kyseliny citronové, fosfatázy, fruktózy, zinku a alfa-glutamyltransferázy svědčí o narušení prostatické sekrece [1]. Snížená koncentrace fruktózy představuje indikátor narušení funkce semenných váčků [20,35].
11.3.9 Protilátky proti spermiím
Sérové protilátky proti antigenům spermií nemají v rámci diagnostiky infertility imunitního původu žádný přínos. Studie dřívějšího data uvádějí souvislost mezi zvýšenou hladinou protilátek proti spermiím v séru a NBP [36,37]. S výjimkou případů podezření na chlamydiovou infekci [38] představuje predikátor tvorby protilátek proti spermiím pouze anamnéza vazektomie [39].
11.3.10 Reaktivní sloučeniny kyslíku
U pacientů s chronickou infekcí močopohlavních cest může být přítomno větší množství reaktivních sloučenin kyslíku, což souvisí se zvýšeným počtem leukocytů [40]. Biologický význam reaktivního kyslíku při onemocnění prostatitidou však stále není prokázán [1].
11.3.11 Léčba
Léčba chronické prostatitidy je obvykle zaměřena na zmírnění symptomů [10,41]. Z andrologického hlediska je léčba narušení složení ejakulátu u mužské adnexitidy (akutní a chronické infekce mužských močopohlavních cest) zaměřena na:
- snížení počtu nebo vymýcení mikroorganizmů v prostatickém exprimátu a ejakulátu
- normalizaci zánětlivých parametrů (např. leukocytů) a sekrečních parametrů
- možnost zlepšení parametrů spermiogramu, které působí proti poškození fertility [42]
Léčba zahrnuje aplikaci antibiotik, protizánětlivých medikamentů, operační zákroky, normalizaci průtoku moči, fyzikální terapii a změnu pohlavního života i celkového životního stylu. Při CBP (NIH II) je pouze aplikace antibiotik schopna zmírňovat symptomy, vymýtit mikroorganizmy a zlepšit buněčné i humorální zánětlivé parametry v urogenitálních sekretech. Aplikace alfablokátorů pro úlevu symptomů je sporná. Přestože může aplikace antibiotik zlepšit kvalitu spermiogramu [42], neexistuje žádný přesvědčivý důkaz, který by nasvědčoval tomu, že léčba chronické prostatitidy zvyšuje pravděpodobnost početí [1,43].
11.4 Orchitida a epididymoorchitida
11.4.1 Úvod
Orchitida je zánětlivá léze varlete spojená s tvorbou leukocytárního exsudátu dovnitř i vně semenných kanálků, jež může potenciálně vést ke skleróze tubulů. Zánět způsobuje bolestivost a otok. Chronické zánětlivé změny v semenných kanálcích narušují normální proces spermatogeneze a způsobují změny v počtu i kvalitě spermií [44]. Orchitida může být rovněž považována za velmi významnou příčinu zástavy spermatogeneze [45], která je ve většině případů reverzibilní. V důsledku tubulární sklerózy může dojít k atrofii varlat [45].
11.4.2 Diagnostika
Pacienti s epididymoorchitidou většinou trpí unilaterální bolestí v šourku [46]. Diagnóza je založena na anamnézea palpačním vyšetření. Ultrazvukové vyšetření obvykle prokáže oteklé a zvětšené varle. Sonografické zobrazení tkáně však neumožňuje stanovit diferenciální diagnózu [47].
11.4.3 Analýza ejakulátu
Analýza ejakulátu zahrnující analýzu leukocytů vykazuje přetrvávající zánětlivou aktivitu. V mnoha případech, zvláště u akutní epididymoorchitidy, se vyskytuje přechodně snížený počet spermií a snížená motilita [44,46]. Obstrukční azoospermie způsobená úplnou obstrukcí se vyskytuje pouze vzácně. Parotická orchitida může způsobit bilaterální testikulární atrofii [45] a neobstrukční azoospermii. V případě podezření na granulomatózní orchitidu jsou přítomny autoprotilátky vázané na spermie.
11.4.4 Léčba
Dosud byl standardizován léčebný postup pouze pro akutní bakteriální epididymoorchitidu a specifickou granulomatózní orchitidu [45] (tab. 13). Některé léčebné režimy zmírňují zánětlivé léze.
Tab. 2. Léčba epididymoorchitidy. 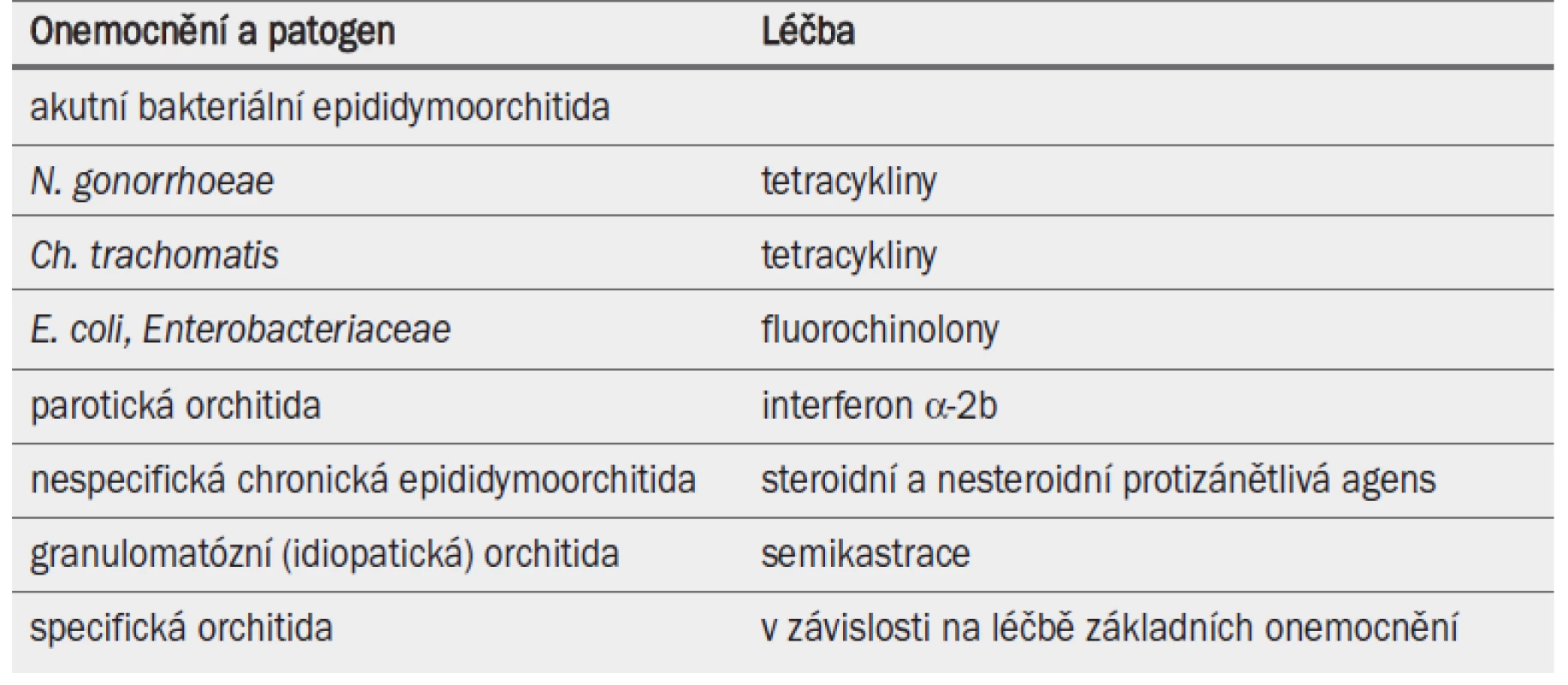
Bohužel nebyl hodnocen andrologický dopad terapie kortikosteroidy ani nesteroidními protizánětlivými přípravky (např. diklofenac, indometacin a kyselina acetylsalicylová) [47]. Bylo prokázáno, že u parotické orchitidy umožňuje systémová terapie interferonem alfa-2B zabránit atrofii varlat a azoospermii [50]. U idiopatické granulomatózní orchitidy je terapií volby operativní odstranění varlete.
11.5 Epididymitida
11.5.1 Úvod
Zánět epididymis způsobuje unilaterální a poměrně akutní bolestivost a otok. U sexuálně aktivních mužů mladších 35 let je epididymitida nejčastěji způsobena Ch. trachomatis nebo N. gonorrhoeae [51,52]. Sexuálně přenosná epididymitida se obvykle vyskytuje v kombinaci s uretritidou.
Epididymitida, která nebyla přenesena pohlavním stykem, bývá spojena s močovou infekcí. Tento typ se častěji vyskytuje u mužů starších 35 let, kteří v nedávné době podstoupili instrumentaci nebo operaci močového ústrojí a kteří mají anatomické abnormality [52].
11.5.2 Diagnostika
U akutní epididymitidy začíná zánět a otok obvykle v ocase nadvarlete a může se rozšířit do zbytku nadvarlete a testikulární tkáně [46]. Přestože jsou muži s epididymitidou získanou sexuálně přenosnými mikroorganizmy vždy sexuálně aktivní, k expozici infekci mohlo dojít i měsíce před jejím propuknutím. Mikrobiologická etiologie epididymitidy je obvykle snadno určitelná barvením podle Grama – vyšetřením uretrálního výtoku na uretritidu a vyšetřením středního proudu moči na gramnegativní bakteriurii [51,52]. Intracelulární gramnegativní diplokoky ve vzorku stěru svědčí o přítomnosti N. gonorrhoeae. Pouze bílé krvinky na uretrálním stěru ukazují na nongonoreální uretritidu; u dvou třetin pacientů bude izolována Ch. trachomatis [53].
11.5.3 Analýza ejakulátu
Analýza ejakulátu podle kritérií WHO zahrnující analýzu leukocytů může ukazo-vat na přetrvávající zánětlivou aktivitu. V mnoha případech dochází k mírnému poklesu počtu spermií a snížení jejich pohyblivosti [46,48,51]. Příčinou tohoto mírného narušení kvality spermií může být ipsilaterální orchitida nízkého stupně [54–56] (tab. 14). Vznik stenózy kanálků nadvarlete, snížení počtu spermií a azoospermie jsou důležitější při sledování bilaterální epididymitidy (viz kap. 5 Obstrukční azoospermie).
Tab. 3. Akutní epididymitida a vliv na parametry ejakulátu. 
Rozsah výskytu azoospermie po epididymitidě zůstává stále nejasný.
11.5.4 Léčba
Před tím, než jsou dostupné výsledky kultivace (tab. 13), je indikována léčba antibiotiky.
Léčba epididymitidy způsobuje:
- mikrobiologické vyléčení infekce
- úlevu klinických znaků a symptomů
- prevenci potenciálního poškození varlete
- prevenci přenosu na další partnery
- menší výskyt potenciálních komplikací (např. infertility nebo chronické bolesti)
U pacientů s epididymitidou způsobenou N. gonorrhoea nebo Ch. trachomatis (nebo podezřením na tuto příčinu) by měly být vyšetřeny a léčeny i jejich sexuální partnerky [60].
11.6 Závěry a doporučení pro léčbu infekce mužských přídatných žláz
Nebylo prokázáno, že by uretritida a prostatitida přímo souvisely s mužskou infertilitou.
Léčba antibiotiky navíc pouze vymýtí mikroorganizmy, nemá však pozitivní účinek na zánětlivé změny ani neodstraní funkční nedostatky a anatomické dysfunkce.
Vzhledem k tomu, že příčina vzniku akutní uretritidy není ve většině případů v době diagnózy známa, doporučuje se empirická terapie s aplikací jedné dávky fluorochinolonu následovaná dvoutýdenní aplikací doxycyklinu. Léčba je účinná při gonokokové i (současně se vyskytující) chlamydiové/ureaplazmatické infekci [9] (stupeň doporučení: B).
Bylo prokázáno, že léčba antibiotiky vede při (chronické) bakteriální prostatitidě ke zmírnění symptomů, vymýcení mikroorganizmů a zlepšení buněčných i humorálních zánětlivých parametrů urogenitální sekrece [61–64] (stupeň doporučení: B).
Přestože může aplikace antibiotik při léčbě MAGI zlepšit kvalitu ejakulátu, terapie nemusí nezbytně zvyšovat pravděpodobnost početí [1,43] (stupeň doporučení: B).
U pacientů s epididymitidou způsobenou N. gonorrhoea nebo Ch. trachomatis (nebo podezřením na tuto příčinu) by měly být vyšetřeny a léčeny i jejich sexuální partnerky (stupeň doporučení: B).
12. Maligní onemocnění ze zárodečných buněk a testikulární mikrokalcifikace
Zdroje
1. Weidner W, Krause W, Ludwig M. Relevance of male accessory gland infection for subsequent fertility with special focus on prostatitis. Hum Reprod Update 1999; 5(5): 421–432. http://www.ncbi.nlm.nih.gov/pubmed/10582781.
2. World Health Organization. WHO Manual for the Standardized Investigation, Diagnosis and Management of the Infertile Male. Cambridge: Cambridge University Press, 2000.
3. Purvis K, Christiansen E. Infection in the male reproductive tract. Impact, diagnosis and treatment in relation to male infertility. Int J Androl 1993; 16(1): 1–13. http://www.ncbi.nlm.nih.gov/pubmed/8468091.
4. Schiefer HG. Microbiology of male urethroadnexitis: diagnostic procedures and criteria for aetiologic classification. Andrologia 1998; 30 (Suppl 1): 7–13. http://www.ncbi.nlm.nih.gov/pubmed/9629437.
5. Chambers RM. The mechanism of infection in the urethra, prostate and epididymis. In: Keith LG, Berger GS, Edelmann DA (eds). Infections in Reproductive Health: Common Infections. Lancaster: MTP Press: 283–296.
6. Ness RB, Markovic N, Carlson CL et al. Do men become infertile after having sexually transmitted urethritis? An epidemiologic examination. Fertil Steril 1997; 68(2): 205–213. http://www.ncbi.nlm.nih.gov/pub.
7. Trum JW, Mol BW, Pannekoek Y et al. Value of detecting leukocytospermia in the diagnosis f genital tract infection in subfertile men. Fertil Steril 1998; 70(2): 315–319. http://www.ncbi.nlm.nih.gov/pubmed/9240243.
8. Purvis K, Christiansen E. The impact of infection on sperm quality. J Br Fertil Soc 1995; 1 : 31–41.
9. Krieger JN. New sexually transmitted diseases treatment guidelines. J Urol 1995; 154(1): 209–213. http://www.ncbi.nlm.nih.gov/pubmed/7776428.
10. Wagenlehner FM, Diemer T, Naber KG, et al. Chronic bacterial prostatitis (NIH type II): diagnosis, therapy and influence on the fertility status. Andrologia 2008; 40(2): 100–104. http://www.ncbi.nlm.nih.gov/pubmed/18336459.
11. Naber KG, Weidner W. Chronic prostatitis-an infectious disease? J Antimicrob Chemother 2000; 46(2): 157–161. http://www.ncbi.nlm.nih.gov/pubmed/10933636.
12. Weidner W, Schiefer HG, Krauss H et al. Chronic prostatitis: a thorough search for etiologically involved microorganisms in 1,461 patients. Infection 1991; 19 (Suppl 3): S119–125. http://www.ncbi.nlm.nih.gov/pubmed/2055646.
13. Bruce AW, Reid G. Prostatitis associated with Chlamydia trachomatis in 6 patients. J Urol 1989; 142(4): 1006–1007. http://www.ncbi.nlm.nih.gov/pubmed/2677408.
14. Taylor-Robinson D. Evaluation and comparison of tests to diagnose Chlamydia trachomatis genital infections. Hum Reprod 1997; 12 (11 Suppl): 113 – 120. http://www.ncbi.nlm.nih.gov/pubmed/9433967.
15. Taylor-Robinson D. Infections due to species of Mycoplasma and Ureaplasma: an update. Clin Infect Dis 1996; 23(4): 671–684. http://www.ncbi.nlm.nih.gov/pubmed/8909826.
16. Krieger JN, Riley DE, Roberts MC et al. Prokaryotic DNA sequences in patients with chronic idiopathic prostatitis. J Clin Microbiol 1996; 34(12): 3120 – 3128. http://www.ncbi.nlm.nih.gov/pubmed/8940458.
17. Litwin MS, McNaughton-Collins M, Fowler FJ Jr. et al. The National Institutes of Health chronic prostatitis symptom index: development and validation of a new outcome measure. Chronic Prostatitis Collaboration Research Network. J Urol 1999; 162(2): 369–375. http://www.ncbi.nlm.nih.gov/pubmed/10411041.
18. Ludwig M, Schroeder-Printzen I, Ludecke G et al. Comparison of expressed prostatic secretions with urine after prostatic massage-a means to diagnose chronic prostatitis/inflammatory chronic pelvic pain syndrome. Urology 2000; 55(2): 175–177. http:// http://www.ncbi.nlm.nih.gov/pubmed/10688073.
19. Liversedge NH, Jenkins JM, Keay SD et al. Antibiotic treatment based on seminal cultures from asymptomatic male partners in in-vitro fertilization is unnecessary and may be detrimental. Hum Reprod 1996; 11(6): 1227–1231. http://www.ncbi.nlm.nih.gov/pubmed/8671429.
20. Weidner W, Krause W, Schiefer HG et al. Ureaplasmal infections of the male urogenital tract, in particular prostatitis, and semen quality. Urol Int 1985; 40(1): 5–9. http://www.ncbi.nlm.nih.gov/pubmed/3883615.
21. Aitken RJ, Baker HW. Seminal leukocytes: passengers, terrorists or good samaritans? Hum Reprod 1995; 10(7): 1736–1739. http://www.ncbi.nlm.nih.gov/pubmed/8582971.
22. Tomlinson MJ, Barratt CLR, Cooke ID. Prospective study of leukocytes and leukocyte subpopulations in semen suggests they are not a cause of male infertility. Fertil Steril 1993; 60(6): 1069–1075. http://www.ncbi.nlm.nih.gov/pubmed/8243688.
23. Krieger JN, Berger RE, Ross SO et al. Seminal fluid findings in men with nonbacterial prostatitis and prostatodynia. J Androl 1996; 17(3): 310–308. http://www.ncbi.nlm.nih.gov/pubmed/8792222.
24. Weidner W, Jantos C, Schiefer HG et al. Semen parameters in men with and without proven chronic prostatitis. Arch Androl 1991; 26(3): 173–183. http://www.ncbi.nlm.nih.gov/pubmed/1872650.
25. Giamarellou H, Tympanidis K, Bitos NA et al. Infertility and chronic prostatitis. Andrologia 1984; 16(5): 417–422. http://www.ncbi.nlm.nih.gov/pubmed/6496959.
26. Christiansen E, Tollefsrud A, Purvis K. Sperm quality in men with chronic abacterial prostatovesiculitis verified by rectal ultrasonography. Urology 1991; 38(6): 545–549. http://www.ncbi.nlm.nih.gov/pubmed/1746084.
27. Leib Z, Bartoov B, Eltes F et al. Reduced semen quality caused by chronic abacterial prostatitis: an enigma or reality? Fertil Steril 1994; 61(6): 1109–1116. http://www.ncbi.nlm.nih.gov/pubmed/8194626.
28. Wolff H, Bezold G, Zebhauser M et al. Impact of clinically silent inflammation on male genital tract organs as reflected by biochemical markers in semen. J Androl 1991; 12(5): 331–334. http://www.ncbi.nlm.nih.gov/pubmed/1765569.
29. Wolff H. The biologic significance of white blood cells in semen. Fertil Steril 1995; 63(6): 1143–1157. http://www.ncbi.nlm.nih.gov/pubmed/7750580.
30. Dousset B, Hussenet F, Daudin M et al. Seminal cytokine concentrations (IL-1beta, IL-2, IL-6, sR IL-2, sR IL-6), semen parameters and blood hormonal status in male infertility. Hum Reprod 1997; 12(7): 1476 – 1479. http://www.ncbi.nlm.nih.gov/pubmed/9262280.
31. Huleihel M, Lunenfeld E, Levy A et al. Distinct expression levels of cytokines and soluble cytokine receptors in seminal plasma of fertile and infertile men. Fertil Steril 1996; 66(1): 135–139. http://www.ncbi.nlm.nih.gov/pubmed/8752625.
32. Shimonovitz S, Barak V, Zacut D et al. High concentration of soluble interleukin-2 receptors in ejaculate with low sperm motility. Hum Reprod 1994; 9(4): 653–655. http://www.ncbi.nlm.nih.gov/pubmed/8046017.
33. Zalata A, Hafez T, van Hoecke MJ et al. Evaluation of beta-endorphin and interleukin-6 in seminal plasma of patients with certain andrological diseases. Hum Reprod 1995; 10(12): 3161–3165. http://www. ncbi.nlm.nih.gov/pubmed/8822435.
34. Alexander RB, Ponniah S, Hasday J et al. Elevated levels of proinflammatory cytokines in the semen of patients with chronic prostatitis/chronic pelvic pain syndrome. Urology 1998; 52(5): 744–749. http://www.ncbi.nlm.nih.gov/pubmed/9801092.
35. Comhaire F, Verschraegen G, Vermeulen L. Diagnosis of accessory gland infection and its possible role in male infertility. Int J Androl 1980; 3(1): 32–45. http://www.ncbi.nlm.nih.gov/pubmed/7409893.
36. Jarow JP, Kirkland JA Jr., Assimos DG. Association of antisperm antibodies with chronic nonbacterial prostatitis. Urology 1990; 36(2): 154–156. http://www.ncbi.nlm.nih.gov/pubmed/2385884.
37. Witkin SS, Zelikovsky G. Immunosuppression and sperm antibody formation in men with prostatitis. J Clin Lab Immunol 1986; 21(1): 7–10. http://www.ncbi.nlm.nih.gov/pubmed/3543373.
38. Munoz MG, Witkin SS. Autoimmunity to spermatozoa, asymptomatic Chlamydia trachomatis genital tract infection and gamma delta T lymphocytes in seminal fluid from the male partners of couples with unexplained infertility. Hum Reprod 1995; 10(5): 1070–1074. http://www.ncbi.nlm.nih.gov/pubmed/7657743.
39. Jarow JP, Sanzone JJ. Risk factors for male partner antisperm antibodies. J Urol 1992; 148(6): 1805–1807. http://www.ncbi.nlm.nih.gov/pubmed/1433613.
40. Depuydt CE, Bosmans E, Zalata A, et al. The relation between reactive oxygen species and cytokines in andrological patients with or without male accessory gland infection. J Androl 1996; 17(6): 699–707. http://www.ncbi.nlm.nih.gov/pubmed/9016401.
41. Schaeffer AJ. Clinical practice. Chronic prostatitis and chronic pelvic pain syndrome. N Engl J Med 2006; 355(16): 1690–1698. http://www.ncbi.nlm.nih.gov/pubmed/17050893.
42. Weidner W, Ludwig M, Miller J. Therapy in male accessory gland infection-what is fact, what is fiction? Andrologia 1998; 30 (Suppl 1): 87–90. http://www.ncbi.nlm.nih.gov/pubmed/9629448.
43. Comhaire FH, Rowe PJ, Farley TM. The effect of doxycycline in infertile couples with male accessory gland infection: a double blind prospective study. IntJ Androl 1986; 9(2): 91–98. http://www.ncbi.nlm.nih.gov/pubmed/3539821.
44. Purvis K, Christiansen E. Infection in the male reproductive tract. Impact, diagnosis and treatment in relation to male infertility. Int J Androl 1993; 16(1): 1–13. http://www.ncbi.nlm.nih.gov/pubmed/8468091.
45. Diemer T, Desjardins C. Disorders of Spermatogenesis. In: Knobil E, Neill JD (eds). Encyclopedia of Reproduction. Vol 4. San Diego: Academic Press 1999 : 546–556.
46. Association of Genitourinary Medicine and the Medical Society for the Study of Venereal Diseases: National guideline for the management of epididymo-orchitis. Sex Transm Infect 1999; 75 (Suppl 1): S51–53. http://www.ncbi.nlm.nih.gov/pubmed/10616385.
47. Weidner W, Garbe C, Weissbach L et al. Initial therapy of acute unilateral epididymitis using ofloxacin. II. Andrological findings. Urologe A 1990; 29(5): 277–280. http://www.ncbi.nlm.nih.gov/pubmed/2120839.
48. Weidner W, Krause W. Orchitis. In: Knobil E, Neill JD (eds). Encyclopedia of Reproduction. Vol. 3. San Diego: Academic Press 1999 : 92–95.
49. Vicari E, Mongioi A. Effectiveness of long-acting gonadotrophin-releasing hormone agonist treatment in combination with conventional therapy on testicular outcome in human orchitis/epididymo-orchitis. Hum Reprod 1995; 10(8): 2072–2078. http://www.ncbi.nlm.nih.gov/pubmed/8567844.
50. Ruther U, Stilz S, Rohl E et al. Successful interferon-alpha 2, a therapy for a patient with acute mumps orchitis. Eur Urol 1995; 27(2): 174–176. http://www.ncbi.nlm.nih.gov/pubmed/7744163.
51. Berger RE, Alexander RE, Harnisch JP et al. Etiology, manifestations and therapy of acute epididymitis: prospective study of 50 cases. J Urol 1979; 121(6): 750–754. http://www.ncbi.nlm.nih.gov/pubmed/379366.
52. Berger RE. Epididymitis. In: Holmes KK, Mardh PA, Sparling PF et al. (eds). Sexually Transmitted Diseases. New York: McGraw-Hill 1984 : 650–662.
53. Weidner W, Schiefer HG, Garbe C. Acute nongonococcal epididymitis. Aetiological and therapeutic aspects. Drugs 1987; 34 (Suppl 1): 111–117. http://www.ncbi.nlm.nih.gov/pubmed/3481311.
54. Nilsson S, Obrant KO, Persson PS. Changes in the testis parenchyma caused by acute non-specific epididymitis. Fertil Steril 1968; 19(5): 748–757. http://www.ncbi.nlm.nih.gov/pubmed/5676481.
55. Osegbe DN. Testicular function after unilateral bacterial epididymo-orchitis. Eur Urol 1991; 19(3): 204–208. http://www.ncbi.nlm.nih.gov/pubmed/1855525.
56. Weidner W, Krause W, Ludwig M. Relevance of male accessory gland infection for subsequent fertility with special focus on prostatitis. Hum Reprod Update 1999; 5(5): 421–432. http://www.ncbi.nlm.nih.gov/pubmed/10582781.
57. Ludwig G, Haselberger J. Epididymitis and fertility. Treatment results in acute unspecific epididymitis. Fortschr Med 1977; 95(7): 397–399. http://www.ncbi.nlm.nih.gov/pubmed/849851.
58. Haidl G. Macrophages in semen are indicative of chronic epididymal infection. Arch Androl 1990; 25(1): 5–11. http://www.ncbi.nlm.nih.gov/pubmed/2389992.
59. Cooper TG, Weidner W, Nieschlag E. The influence of inflammation of the human genital tract on secretion of the seminal markers alpha-glucosidase, glycerophosphocholine, carnitine, fructose and citric acid. Int J Androl 1990; 13(5): 329–336. http://www.ncbi.nlm.nih.gov/pubmed/2283178.
60. Robinson AJ, Grant JB, Spencer RC et al. Acute epididymitis: why patient and consort must be investigated. Br J Urol 1990; 66(6): 642–645. http://www.ncbi.nlm.nih.gov/pubmed/2265337.
61. Schneede P, Tenke P, Hofstetter AG. Urinary Tract Infection Working Group of the Health Care Office of the European Association of Urology. Sexually transmitted diseases (STDs)-a synoptic overview for urologists. Eur Urol 2003; 44(1): 1–7. http://www.ncbi.nlm.nih.gov/pubmed/12814668.
62. Schaeffer AJ, Weidner W, Barbalias GA et al. Summary consensus statement: diagnosis and management of chronic prostatitis/chronic pelvic pain syndrome. Eur Urol 2003; (Suppl 2): 1–4.
63. Alexander RB, Propert KJ, Schaeffer AJ et al. Chronic Prostatitis Collaborative Research Network. Ciprofloxacin or tamsulosin in men with chronic prostatitis/chronic pelvic pain syndrome: a randomized, double-blind trial. Ann Intern Med 2004; 141(8): 581–589. http://www.ncbi.nlm.nih.gov/pubmed/15492337.
64. Nickel JC, Narayan P, McKay J et al. Treatment of chronic prostatitis/chronic pelvic pain syndrome with tamsulosin: a randomized double blind trial. J Urol 2004; 171(4): 1594–1597. http://www.ncbi.nlm.nih.gov/pubmed/15017228.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2012 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Vedlejší účinky hormonální substituční léčby testosteronem
- Vývoj chirurgického odběru spermií u mužů s azoospermií
- Adenomatoidní tumor varlete – diagnostika a doporučené operační postupy
- Vaporizace prostaty pomocí zeleného laseru (GreenLight laser) – zkušenost z jednoho centra po provedení více než 1 000 výkonů
- Syntetický miduretrální sling při léčbě močové inkontinence u žen: analýza 1 000 případů z jednoho centra
- Slovo úvodem
- Virulentný profil a rezistencia Escherichia coli izolovaných od imunokompromitovaných pacientov pri urosepse
- Sekvence léčby a sledování pacienta s metastatickým kastračně rezistentním karcinomem prostaty
-
Guidelines EAU pro léčbu mužské infertility
1. Metodologie -
Guidelines EAU pro léčbu mužské infertility
2. Vyšetření -
Guidelines EAU pro léčbu mužské infertility
3. Testikulární nedostatečnost (selhání spermatogeneze) -
Guidelines EAU pro léčbu mužské infertility
4. Genetické poruchy u infertilních mužů -
Guidelines EAU pro léčbu mužské infertility
5. Obstrukční azoospermie - Nádory penisu spojené s výskytem dalších novotvarů
-
Guidelines EAU pro léčbu mužské infertility
6. Varikokéla -
Guidelines EAU pro léčbu mužské infertility
7. Hypogonadizmus -
Guidelines EAU pro léčbu mužské infertility
8. Kryptorchizmus -
Guidelines EAU pro léčbu mužské infertility
9. Idiopatická mužská infertilita -
Guidelines EAU pro léčbu mužské infertility
10. Mužská antikoncepce -
Guidelines EAU pro léčbu mužské infertility
11. Infekce mužských přídatných žláz -
Guidelines EAU pro léčbu mužské infertility
12. Maligní onemocnění ze zárodečných buněk a testikulární mikrokalcifikace -
Guidelines EAU pro léčbu mužské infertility
13. Poruchy ejakulace -
Guidelines EAU pro léčbu mužské infertility
14. Kryoprezervace ejakulátu -
Guidelines EAU pro léčbu mužské infertility
15. Zkratky užité v textu
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vedlejší účinky hormonální substituční léčby testosteronem
- Adenomatoidní tumor varlete – diagnostika a doporučené operační postupy
-
Guidelines EAU pro léčbu mužské infertility
13. Poruchy ejakulace -
Guidelines EAU pro léčbu mužské infertility
5. Obstrukční azoospermie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



