-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současný stav strategie léčby karcinomu rekta v České republice s ohledem na výskyt kompletní patologické odpovědi při neoadjuvantní léčbě – studie PATOD C20 2011–2012
Current status in the treatment of rectal cancer in the Czech Republic regarding the rate of complete pathological response after neoadjuvant therapy – PATOD C20 study 2011−2012
Introduction:
Deciding on the strategy in rectal cancer´s treatment requires a complex and multidisciplinary approach. The primary rectal resection is indicated in early stages, while locally advanced tumors should be pretreated by one of the modes of neoadjuvant (chemo) radiotherapy. The main goal of this study was to explore the therapeutic strategy in patients with rectal cancer in the Czech Republic. The second aim was to determine the incidence of the pathological complete response after neoadjuvant therapy.Methods:
This is a retrospective multicenter clinical study, which includes data from all patients with rectal cancer who were treated at participating centers in the period from 01/01/2011 to 31/12/2012. The required data has been passed into the online registry PATOD C20.Three issues have been set up: 1. Characteristics of the center and cooperation with the oncological department; 2. Characteristics of the treatment of patients with rectal cancer; and 3. Detailed analysis of the group of patients with complete pathological response. The analysis was performed with regard to the nature of individual departments, i.e. departments of surgery in university hospitals with complex oncological centres, departments of surgery within complex oncologic centers, and departments of surgery outside complex oncologic centersResults:
In total, 21 departments of surgery in the Czech Republic provided data about 1860 patients with rectal cancer for the study. The treatment strategy for rectal cancer was determined at multidisciplinary seminars at 19 centers (90.5%). Statistically significant differences between the centers were found in the indication for neoadjuvant treatment (p<0.001), rectal resection with anastomosis (p = 0.048), and resection without anastomosis (p = 0.022). Complete pathological response was found in 61 (8.7%) patients. Positivity of mesorectal lymph nodes (ypN+) was found in the case of ypT0 stage in 7 (9.7%) patients.Conclusion:
PATOD study showed that therapy of rectal cancer is highly heterogeneous in the Czech Republic. Despite the best conditions provided, university hospitals and large departments within complex oncologic centers do not fully utilize this benefit.Key words:
rectal cancer – neoadjuvant therapy – chemoradiotherapy – complete pathological response
Autoři: T. Dušek 1,2; A. Ferko 1; M. Bláha 3; L. Dušek 3; D. Malúšková 3; J. Örhalmi 1; J. Dolejš 4; M. Vošmik 5
Působiště autorů: Chirurgická klinika FN Hradec Králové a Lékařské fakulty UK v Hradci Králové přednosta kliniky: prof. MUDr. A. Ferko, CSc. 1; Katedra vojenské chirurgie, Fakulta vojenského zdravotnictví, Hradec Králové, Univerzita obrany, Brno vedoucí: doc. MUDr. J. Páral, Ph. D. 2; Institut biostatistiky a analýz Lékařské a Přírodovědecké fakulty Masarykovy univerzity, Brno ředitel doc. RNDr. L. Dušek, Ph. D. 3; Katedra informatiky a kvantitativních metod, Fakulta informatiky a managementu, Univerzita v Hradci Králové vedoucí katedry: doc. RNDr. P. Pražák, Ph. D. 4; Klinika onkologie a radiologie FN Hradec Králové a Lékařské fakulty UK v Hradci Králové přednosta kliniky: prof. MUDr. J. Petera, Ph. D. 5
Vyšlo v časopise: Rozhl. Chir., 2015, roč. 94, č. 7, s. 276-282.
Kategorie: Původní práce
Souhrn
Úvod:
Stanovení strategie léčby karcinomu rekta vyžaduje komplexní a multidisciplinární přístup, na základě kterého je indikována racionální léčba. K primární resekci jsou indikována časná stadia karcinomu rekta, naopak lokálně pokročilé tumory by měly být předléčeny některým z režimů předoperační (chemo)radioterapie. Hlavním cílem této práce bylo zmapovat strategii léčby pacientů s karcinomem rekta v České republice a zejména sledovat výskyt kompletní patologické odpovědi při neoadjuvantní léčbě.Metody:
Jde o retrospektivní multicentrickou klinickou studii, která zahrnuje data všech pacientů s karcinomem rekta, kteří byli operováni v zúčastněných centrech v období od 1. 1. 2011 do 31. 12. 2012. Požadovaná data byla zadávána do online registru PATOD C20. Byly stanoveny tři okruhy otázek: 1. charakteristika pracoviště a spolupráce s onkologií; 2. analýza léčby pacientů s karcinomem rekta; 3. detailní analýza skupiny pacientů s kompletní patologickou odpovědí. Analýza byla provedena s ohledem na charakter jednotlivých pracovišť, tj. univerzitní centra s KOC, neuniverzitní centra s KOC a centra mimo KOC.Výsledky:
Do studie bylo zařazeno celkem 21 chirurgických pracovišť České republiky, která poskytla data 1860 pacientů. Strategie léčby karcinomu rekta byla určována mezioborovými semináři v 19 centrech (90,5 %). Statisticky významné rozdíly byly zjištěny mezi jednotlivými centry v indikaci neoadjuvantní léčby (p<0,001), provedených resekcí rekta s anastomózou (p=0,048) a resekcí bez anastomózy (p=0,022). Kompletní patologická odpověď byla nalezena celkem u 61 (8,7 %) pacientů. Postižení lymfatických uzlin (ypN+) bylo nalezeno v případě vymizení tumoru ve stěně rekta (ypT0) u celkem 7 (9,7 %) pacientů.Závěr:
Studie PATOD prokázala, že péče o karcinom rekta je v ČR velmi heterogenní. Univerzitní a velká centra při KOC, i přes vytvořené nejlepší podmínky, této výhody plně nevyužívají.Klíčová slova:
karcinom rekta – neoadjuvantní terapie – chemoradioterapie – kompletní patologická odpověďÚvod
Stanovení strategie léčby karcinomu rekta vyžaduje komplexní a multidisciplinární přístup, na základě kterého je indikována racionální léčba přinášející benefit pro pacienta. Tím je zejména snaha o maximální snížení rizika z přeléčení nebo naopak podléčení tumoru. Časné karcinomy (T1-2N0, T3N0 bez ohrožení cirkumferentního okraje) jsou indikovány k primární chirurgické léčbě. U lokálně pokročilých tumorů (T3-T4, N+) a s dalšími rizikovými faktory, jako jsou nízký grading tumoru, extramurální lymfovaskulární invaze, perineurální šíření, je upřednostňována předoperační onkologická léčba v různých režimech [1,2]. O jejím typu a délce rozhoduje kromě stagingu onemocnění také celkový stav nemocného a jeho závažné komorbidity [3]. Smyslem neoadjuvantní léčby je zvýšení pravděpodobnosti radikální resekce, snížení rizika vzniku lokální recidivy a také zvýšení pravděpodobnosti provedení sfinkter zachovávajícího výkonu.
Hlavním cílem naší studie bylo zmapovat současnou strategii léčby pacientů s karcinomem rekta v České republice a sledovat zejména výskyt kompletní patologické odpovědi tumoru na neoadjuvantní léčbu.
Metoda
Jedná se o retrospektivní multicentrickou klinickou studii, která zahrnuje data všech pacientů s karcinomem rekta, kteří byli operováni v zúčastněných centrech v období od 1. 1. 2011 do 31. 12. 2012. Požadovaná data byla zadávána do online registru PATOD C20.
Byly stanoveny tři základní okruhy otázek:
- charakteristika pracoviště a spolupráce s onkologií – zda byly organizovány mezioborové indikační semináře;
- analýza léčby pacientů s karcinomem rekta – přehled typů a počtu výkonů na jednotlivých pracovištích, obvyklá strategie předoperační onkologické léčby a timing výkonu po jejím ukončení;
- bližší analýza skupiny pacientů s kompletní patologickou odpovědí – typy provedených výkonů, předléčebná a poléčebná TNM klasifikace, typy provedených výkonů, počet vyšetřených lymfatických uzlin a grading tumoru.
Pro detailní analýzu byla pracoviště rozdělena do skupin podle jejich charakteru na univerzitní v rámci KOC (U-KOC), neuniverzitní v rámci KOC (NeU-KOC) a chirurgická oddělení fungující mimo KOC (Ne-KOC).
Statistická analýza
Statistická analýza byla provedena v programu SPSS Statistics 22.0 software (SPSS Inc., Chicago, IL, USA. P-hodnota menší než 0,05 byla považována za statisticky významnou.
Výsledky
Ve sledovaném období bylo do projektu zapojeno 21 chirurgických center ze 12 krajů České republiky, celkem bylo do studie zařazeno 1860 pacientů.
Na první skupinu otázek byly zaznamenány následující reakce: mezioborové indikační týmy určují strategii léčby karcinomu rekta v 19 (90,5 %) centrech. Spolupráci s onkologií hodnotí jako dobrou 76,2 % chirurgických pracovišť a jako uspokojivou 23,8 %.
V zařízeních U-KOC bylo léčeno celkem 1230 nemocných (66,1 %); v NeU-KOC 382 (20,5 %) pacientů a v Ne-KOC 248 pacientů (13,4 %). Neoadjuvantní léčba byla indikována celkem u 699 (37,6 %) pacientů.
V rámci U-KOC pracovišť byla provedena u 481 (39,1 %) pacientů. Podobné výsledky vykazují i NeU-KOC pracoviště (160 pacientů, 41,9 %). Ne-KOC zařízení mimo komplexní onkologická centra indikovala předoperační léčbu ve 23,4 % (58 pacientů). Zde byly rozdíly statisticky rozdílné (p=0,001).
Režim neoadjuvantní chemoradioterapie volí k primární léčbě pacientů s karcinomem rekta 11 (91,7 %) U-KOC pracovišť, všechna NeU-KOC a 67 % Ne-KOC pracovišť. Pouze ve dvou centrech je obvyklým typem léčby dlouhý režim radioterapie a v jednom Ne-KOC centru je nejčastěji indikován předoperační krátký režim ozáření, p=0,116. Ani v případě timingu mezi ukončením neoadjuvantní léčby a operací nebyl mezi centry zjištěn statistický rozdíl (p=0,116).
Paliativní stomie byly provedeny na U-KOC u 126 (10,2 %) pacientů, u 25 (6,5 %) pacientů v NeU-KOC a 22 (8,9 %) Ne-KOC nemocnicích, p=0,114. Resekční výkony s anastomózou, tedy sfinkter zachovávající výkony, byly v rámci U-KOC nemocnic provedeny v 652 případech (53,0 %), v NeU-KOC zařízeních u 214 pacientů (56,0 %) a v Ne-KOC u 163 pacientů (65,7 %). Zde byly rozdíly mezi centry statisticky významné (p=0,048). Resekce rekta bez anastomózy byly provedeny na U-KOC pracovištích u 321 pacientů (26,1 %), na NeU-KOC pracovištích u 110 pacientů (28,8 %) a na Ne-KOC odděleních ve 44 (17,7 %) případech. I v této skupině byly rozdíly statisticky významné, p=0,022. Exenterace pánve byly vázány převážně na univerzitní pracoviště (17 pacientů, 1,4 %), v jednom případě (0,3 %) byla exenterace provedena v krajském zařízení, p=0,038. Transanální miniinvazivní excize byla provedena na U-KOC pracovištích u 88 (7,2 %) pacientů, v NeU-KOC zařízeních u 23 (6,0 %) pacientů a na Ne-KOC pracovištích u 15 (6,1 %) pacientů, p=0,679. Neurčených nebo jiných výkonů bylo provedeno celkem 39 (2,1 %), p=0,818, Tab. 1. Incidenci jednotlivých výkonů mezi centry znázorňuje Graf 1.
Graf 1. Incidence výkonů mezi centry Graph 1: Incidence of surgery types among the centers 
Tab. 1. Charakteristika pacientů v jednotlivých centrech Tab.1: Characteristics of patients at individual centers 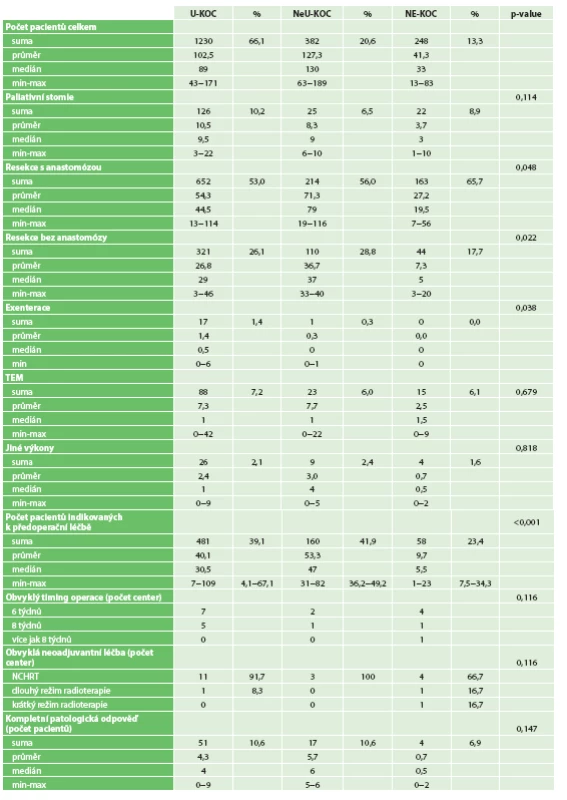
Analýza souboru pacientů s dosaženým ypT0 stadiem
ypT0 stadium bylo nalezeno celkem u 72 (10,3 %) pacientů v 17 centrech. Jeho zastoupení bylo v U-KOC centrech u 51 pacientů (10,6 %), v NeU-KOC pracovištích u 17 pacientů (10,6 %) a v Ne-KOC nemocnicích ve čtyřech případech (6,9 %), p= 0,147.
Poléčebné yT0 stadium bylo zjištěno u 11 pacientů (15,3 %), yT1 dosáhli 4 pacienti (5,6 %), yT2 18 pacientů (25,0 %). Stadium yT3 bylo identifikováno u 8 pacientů (11,1 %) a 1 (1,4 %) pacient měl yT4. U 30 (41,6 %) pacientů nebylo yT stadium určeno. yN0 stadium bylo identifikováno před operací u 37 pacientů (51,4 %), yN1 u 4 (5,6 %) a yN2 u žádného. Neurčené yN bylo u 31 (43,0 %) pacientů. yM0 bylo nalezeno u 38 (52,8 %) pacientů, yM1 u 1 (1,4 %). Neurčené M stadium zůstalo u 33 (45,8 %) pacientů. ypT0 bylo zjištěno u 45 (62,5 %) pacientů s resekcí rekta, ve 26 (36,1 %) případech u amputačních výkonů a u 1 pacienta (1,4 %) po jiném typu výkonu. V resekátech po Hartmannově operaci, exenteraci pánve a po TEM nebyla kompletní odpověď nalezena. Průměrný počet odebraných uzlin v resekátu byl 10, pouze ve 4 centrech byl ale medián vyšetřených uzlin vyšší než 12.
Kompletní patologické odpovědi (ypT0N0) bylo dosaženo u 61 pacientů (8,7 %) z celkového počtu 699 pacientů, kteří absolvovali neoadjuvantní léčbu. Postižení lymfatických uzlin bylo při ypT0 nalezeno celkem u 7 (9,7 %) pacientů. Nodální stadium nebylo v této skupině určeno u 4 (5,6 %) pacientů.
Dobře diferencovaný karcinom byl popsán u 9 (12,5 %) pacientů, středně diferencovaný karcinom ve 33 (45,8 %) případech a u 5 (6,9 %) pacientů byl nalezen nízce diferencovaný karcinom. Grading nebyl stanoven ve 25 případech (34,7 %), Tab. 2.
Tab. 2. Pacienti s kompletní patologickou odpovědí Tab. 2: Patients with complete pathological response 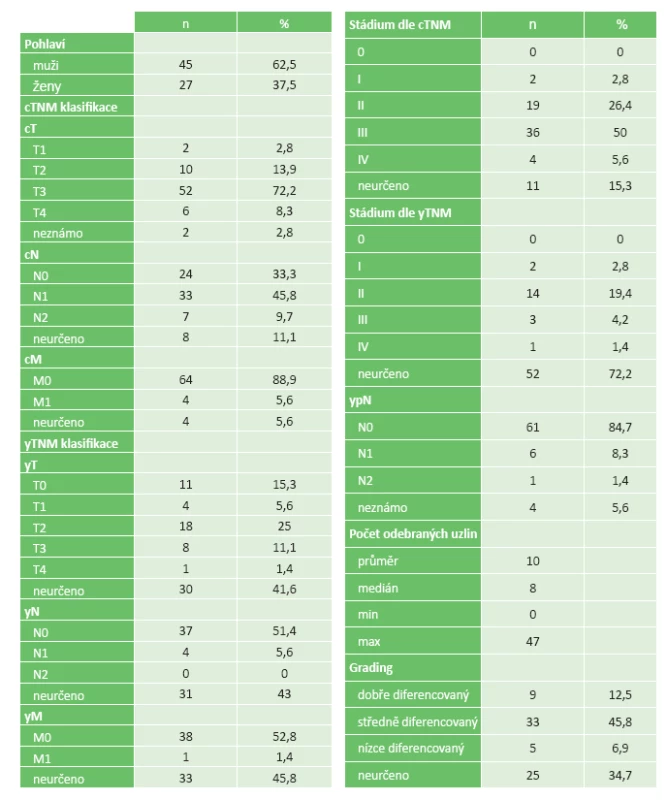
Diskuze
Předoperační onkologická léčba následovaná TME je nyní zlatým standardem léčby lokálně pokročilého karcinomu rekta [4,5]. Radioterapie krátkým režimem (5x5 Gy) s odstupem 8 týdnů před výkonem je preferovaná zejména ve skandinávských zemích a v Severní Americe. Naopak dlouhý režim radioterapie s konkomitantní chemoterapií (NCHRT) je standardem v ostatních evropských zemích [6]. Velmi podobné výsledky dokazuje i naše studie, kde v předoperační léčbě jednoznačně dominoval režim neoadjuvantní chemoradioterapie (Tab. 2).
Rozdíly mezi různými předoperačními režimy (krátký režim radioterapie vs. dlouhý režim radioterapie s konkomitantní chemoterapií) zpracovává studie „Trans Tasman Radiation Oncology Group Trial 01.04“: V pětiletém sledovacím období studie nebyl prokázán rozdíl v lokální recidivě (7,5 % vs. 5,7 %), mezi distančními metastázami (27 % vs. 30 %) ani v celkovém přežití (74 % vs. 70 %) [7]. Podobné výsledky přinesla i polská studie porovnávající dlouhý a krátký režim radioterapie aplikované na T3-T4 tumory středního a dolního rekta. Také zde nebyly popsány rozdíly mezi lokální recidivou, celkovým přežitím ani disease free intervalem [8]. Rozsáhlou studii porovnávající výskyt lokální recidivy po neoadjuvantní chemoradioterapii, resp. adjuvantní chemoradioterapii, publikoval Sauer a spol. V případě předoperační CHRT byla recidiva zaznamenána v 7,1 %, při pooperační CHRT v 10,1 % (p=0,48). Nebyly nalezeny ani rozdíly v incidenci vzdálených metastáz a DFS [9].
Podléčení nebo přeléčení onemocnění je vázáno hlavně na skupinu T3 nádorů, u kterých není správně stanoveno zejména cN stadium. Podléčení nádoru vede k výskytu časných lokálních recidiv, zejména vlivem neradikálních resekcí. Přeléčení nádoru s sebou přináší zvýšené riziko časné i pozdní toxicity aplikované chemoterapie. Dále je prokázán vliv předoperační radioterapie na vyšší incidenci poruch hojení anastomózy [8,10,11].
Významná heterogenita hlavně mezi jednotlivými univerzitními pracovišti je patrná v indikacích neoadjuvantní terapie. Jedno z U-KOC center indikovalo předoperační léčbu pouze u 4,1 % pacientů, zatímco celkem v U-KOC pracovištích absolvovalo předoperační léčbu 39,1 % pacientů, v NeU-KOC centrech 41,9 % a v Ne-KOC nemocnicích 23,4 %.
Jaké mohou být důvody těchto rozdílů? Elliot et al. zjistil, že „high-volume“ centra (>40 pacientů/rok) indikovala předoperační CHRT častěji než centra s menším počtem pacientů (OR 1,42). Ze stejné práce vyplývá, že pacienti diskutovaní na mezioborových seminářích byli indikováni k neoadjuvanci v 75,2 %. Mimo mezioborové semináře bylo určeno k předoperační léčbě pouze 44,1 % pacientů [12].
Při analýze skupiny pacientů s resekcí a anastomózou byly zjištěny statisticky významné rozdíly mezi Ne-KOC centry a centry při KOC (65,7 % vs. 53,0, resp. 56,0 %). Důvody mohou být různé. Můžeme předpokládat, že v centrech při KOC se koncentrují pacienti ve vyšším stadiu onemocnění. Nemáme ale zdrojová data ohledně stagingu. I mezi univerzitními pracovišti jsou markantní rozdíly. Pokud bychom brali jako ukazatel kvality poměr sfinkter záchovných operací, tak nelze tvrdit, že chirurgická pracoviště mimo KOC poskytují méně kvalitní péči.
Kompletní patologická odpověď (PCR) je definována jako úplné vymizení nádorových buněk v místě primárního nádoru. V resekátu jsou mikroskopicky nalezeny pouze jizevnaté změny. Tento stav je definován v Dworakově klasifikaci odpovědi tumoru na předoperační léčbu stupněm 4 (100% odpověď) [13,14]. Výskyt kompletní patologické odpovědi je popisován v různých studiích v širokém intervalu od 5−30 %, v našem souboru to bylo v 8,7 % [13,15,16,17]. Toto procento se zvyšuje s prodlužujícím se intervalem mezi ukončením chemoradioterapie a operačním výkonem [13,18,19,20]. To koresponduje i s výsledky polské studie, kde PCR byla nalezena v 16 % po dlouhém režimu radioterapie, zatímco po krátkém režimu 5x5 Gy dosáhlo PCR pouze 1 % pacientů. Vysvětlením může být právě velmi krátký interval mezi ukončením ozáření a operací [8]. Naopak asi 10−40 % pacientů jsou rezistentní vůči radioterapii a nedochází u nich k zásadní odpovědi tumoru [21].
Dobře je již popsána závislost mezi kompletní odpovědí a dlouhodobými výsledky léčby karcinomu rekta. V metaanalýze zahrnující celkem 3105 pacientů bylo PCR dosaženo u 484 pacientů (15,6 %). Pacienti s cT1-2 dosahovali PCR častěji než pacienti s lokálně pokročilým tumorem. 5leté přežití mělo 83,3 % u pacientů s PCR, pacienti bez PCR měli přežití v 65,6 %. Stejný signifikantní rozdíl byl nalezen i u výskytu lokální recidivy onemocnění. Ve skupině s PCR byla lokální recidiva zastižena ve 2,8 %, zatímco skupina bez PCR měla lokální recidivu 9,8 % [20]. Důvod, proč pacienti s PCR mají lepší prognózu než pacienti, u kterých nedošlo ke kompletní odpovědi, je zřejmě v lepším biologickém profilu tumoru. Ten vykazuje menší sklon ke vzniku lokální recidivy a zakládání vzdálených metastáz [20].
Lepší odpověď na léčbu s sebou přináší kromě nadějných dlouhodobých výsledků i vyšší pravděpodobnost provádět sfinkter zachovávající výkony i u velmi nízce uložených tumorů.
Snahou je samozřejmě identifikovat pacienty, kteří mohou dosáhnout kompletní patologické odpovědi, u kterých by bylo možné postupovat bez chirurgické léčby na základě tzv. principu „wait and see“ [22]. Predikce PCR u pacientů je ale stále obtížná i přes snahy nalézt prediktivní faktory, pomocí kterých by bylo možné tyto pacienty identifikovat. V práci Garcia-Floreze se právě studiem faktorů, které ovlivňují odpověď na předoperační léčbu, zabývali. Multivariantní analýzou zjistili, že grading tumoru a exprese Bcl-2 biomarkeru jsou nezávislými faktory pro dobrou odpověď tumoru na onkologickou léčbu [23].
Ani na základě zobrazovacích metod není možné přesně identifikovat pacienta s PCR. Při příznivém slizničním nálezu (jizva, ulcerace) nemůže být spolehlivě vyloučen reziduální nádor v hlubších vrstvách stěny rekta anebo v mezorektu.
I při úplné regresi tumoru ve stěně rekta existuje riziko uzlinového postižení mezorekta (ypT0 ypN+), které se vyskytuje ve významném intervalu 6−17 % [24,25,26]. V našem souboru mělo ze 72 pacientů s ypT0 uzlinové postižení 7 (9,7 %) pacientů.
Ve studii PATOD pouze 4 centra dosahovala mediánu 12 a více odebraných a vyšetřených uzlin v resekátu. To ukazuje zřejmě na zatím ne zcela precizní techniku histopatologického zpracování resekátu.
Závěr
I když má studie PATOD metodické nedostatky a může spíše ukazovat směry dalšího zkoumání, ukazuje se, že péče o karcinom rekta je v ČR velmi heterogenní. Je zřejmé, že karcinom rekta vyžaduje mezioborový přístup a univerzitní a velká centra v rámci KOC mají vytvořené nejlepší podmínky. Na straně druhé je možné pozorovat, že mnohá centra této výhody nevyužívají.
Poděkování
Autoři srdečně děkují následujícím pracovištím, která se zúčastnila studie PATOD C20:
FN Motol – III. Chirurgická klinika, přednosta prof. MUDr. Robert Lischke, Ph.D.; FN Na Bulovce Praha – Chirurgická klinika, prof. MUDr. František Antoš, CSc.; FN KV Praha – Chirurgická klinika a 3. LF UK, přednosta prof. MUDr. Robert Gürlich, CSc.; VFN Praha – I. Chirurgická klinika, přednosta prof. MUDr. Zdeněk Krška, DrSc.; ÚVN – Chirurgická klinika 2. LF UK a ÚVN, přednosta prof. MUDr. Miroslav Ryska, CSc.; TN Praha – Chirurgická klinika 1. LF UK a TN, přednosta doc. MUDr. Jaromír Šimša, Ph.D.; Písek – Chirurgické odd., primář MUDr. Vladimír Cejp; FN Plzeň – Chirurgická klinika, přednosta prof. MUDr. Vladislav Třeška, DrSc.; Jablonec nad Nisou – Chirurgické odd., primář MUDr. Michael Vraný; FN HK – Chirurgická klinika, přednosta prof. MUDr. Alexander Ferko, CSc.; Náchod – Chirurgické oddělení, primář MUDr. Jaroslav Vokůrka; KN Pardubice – Chirurgická klinika, přednosta doc. MUDr. Jiří Šiller, Ph.D.; Orlickoústecká nemocnice – Chirurgické odd., MUDr. Josef Žižka; Jihlava – Chirurgické odd., primář MUDr. Jaromír Meduna; FN Brno-Bohunice – Chirurgická klinika, přednosta prof. MUDr. Zdeněk Kala, CSc.; FN USA Brno – I. chirurgická klinika, přednosta prof. MUDr. Ivan Čapov, CSc.; FN Olomouc – I. chirurgická klinika, přednosta prof. MUDr. Čestmír Neoral, CSc.; Nemocnice Atlas, Zlín – Chirurgické oddělení, primář MUDr. Jiří Gatěk, Ph.D.; Nový Jičín – Chirurgické odd., primář MUDr. Matej Škrovina, Ph.D.; FN Ostrava – Chirurgická klinika, přednosta doc. MUDr. Pavel Zonča, Ph.D., FRCS.; Vítkovická nem., a. s. – Chirurgické oddělení, primář doc. MUDr. Pavol Holéczy, CSc.
Použité zkratky:
U-KOC – univerzitní pracoviště při komplexním onkologickém centru
NeU-KOC – neuniverzitní pracoviště při komplexním onkologickém centru
Ne-KOC – pracoviště mimo komplexní onkologické centrum
TEM – transanální endoskopická mikrochirurgie
TME – totální mezorektální excize
CHRT – chemoradioterapie
NCHRT – neoadjuvantní chemoradioterapie
PCR – patologická kompletní odpověď
DFS – disease free survival
Podpořeno MZ ČR – RVO (FNHK, 00179906)
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Tomáš Dušek
Chirurgická klinika
Fakultní nemocnice Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: tomas.dusek@fnhk.cz
Zdroje
1. Nussbaum N, Altomare I. The neoadjuvant treatment of the rectal cancer: a review. Curr Oncol Rep 2015;17 : 434.
2. Valentini V, Aristei C, Glimelius B, et al. Multidisciplinary rectal cancer management: 2nd European Rectal Cancer Consensus Conference (EURECA-CC2). Radiother Oncol 2009;92 : 148−63.
3. van Leersum NJ, Janssen-Heijnen MLG, et al. Incresing of comorbidity in patients with colorectal cancer in the South Netherlands 1995-2010. Int J Cancer 2013;132 : 2157−63.
4. Hoch J. Chirurgická léčba kolorektálního karcinomu. Rozhl Chir 2012; 91 : 48−52.
5. Dušek T, Ferko A, Örhalmi J, et al. Karcinom rekta do 10 cm (Srovnání radikality laparoskopické a otevřené operační techniky s ohledem na cirkumferentní resekční okraj a na kompletnost mezorektální excize.) Rozhl Chir 2013; 92 : 20−6.
6. Monson JRT, Weiser MR, Buie WD, et al. Practice parameters for the management of rectal cancer (revised). Dis Col Rectum 2013;56 : 535−50.
7. Ngan SY, Burmeister B, Fischer RJ, et al. Randomized trial of short course radiotherapy versus longe course chemoradiation comparing rates of local recurrence in patients with T3 rectal cancer. Trans Tasman Radiation Oncology Group Trial 01.04. J Clin Oncol 2012;30 : 3827−33.
8. Bujko K, Nowacki MP, Nasierowska-Guttmejer A, et al. Long-term results of a randomized trial comparing preoperative short-course radiotherapy with preoperative conventionally fractionated chemoradiation for rectal cancer. Br J Surg 2006;93 : 1215−23.
9. Sauer R, Liersch T, Merkel S. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol 2012;30 : 1926−33.
10. Fucini C, Pucciani F, Elbetti C, et al. Preoperative radiochemotherapy in T3 operable low rectal cancers: A gold standard? World J Surg 2010;34 : 1609−14.
11. Lombardi R, Cuicchi D, Pinto C, et al. Clinically-staged T3N0 rectal cancer: Is preoperative chemoradiotherapy the optimal treatment? Ann Surg Oncol 2010;17 : 838−45.
12. Elliot AH, Martling A, Glimelius B, et al. Preoperative treatment selection in rectal cancer: A population-based cohort study. Eur J Surg Oncol 2014 40 : 1782−8.
13. Sauer R, Becker H, Hohenberger W, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004;351 : 1731−40.
14. Dworak O, Keilholz L, Hoffmann A, et al. Pathological features of rectal cancer after preoperative radiochemotherapy. Int J Colorect Dis 2007;12 : 19−23.
15. Stipa F, Picchio M, Burza A, et al. Long-term outcome of local excision after preoperative chemoradiation for ypT0 rectal cancer. Dis Col Rectum 2014;57 : 1245−52.
16. Sinukumar S, Patil P, Enginner R, et al. Clinical outcome of patients with complete pathological response to neoadjuvant chemoradiotherapy for locally advanced rectal cancers: the Indian scenario. Gastroenterol Res Pract 2014; Published online doi: 10.1155/2014/867841.
17. Sclafani F, Cunningham D, et al. Neoadjuvant chemotherapy without radiotherapy for locally advanced rectal cancer. Future Oncol 2014;10.2243−57.
18. Kapiteijn E, Marijnen CAM, Nagtegaal ID, et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med 2001;345 : 638−46.
19. Garcia-Aguilar J, Smith DD, Avila K, et al. Optimal timing of surgery after chemoradiation for advanced rectal cancer. Preliminary results of multi-center, non-randomized phase II prospective trial. Ann Surg 2011;254 : 97−102.
20. Maas M, Nelemans PJ, Valentini V, et al. Long-term outcome in patients with a pathologial complete response after chemoradiation for rectal cancer: a pooled analysis of individual patient data. Lancet Oncol 2010;11 : 835−44.
21. Rödel C, Martus P, Papadoupolos T, et al. Prognostic significance of tumor regression after preoperative chemoradiotherapy for rectal cancer. J Clin Oncol 2005;23 : 8688−96.
22. Berardi R, Maccaroni E, Onofri A, et al. Locally advanced rectal cancer: the importance of a multidisciplinary approach. World J Gastroenterol 2014;20 : 17279−87.
23. García-Flórez LJ, Gómez-Álvarez G, Grunza AM, et al. Predictive markers of response to neoadjuvant therapy in rectal cancer. J Surg Res 2015;194 : 120−6.
24. Yeo SG, Kim DY, Kim TH, et al. Pathologic complete response of primary tumour following preoperative chemoradiotherapy for locally advanced rectal cancer: Long-term outcomes and prognostic significance of pathologic nodal status (KROG 09-01). Ann Surg 2010;252 : 998−1004.
25. Hughes R, Glynne-Jones R, Grainger J, et al. Can pathological complete response in the primary tomour following preoperative pelvic chemoradiotherapy for T3-T4 rectal cancer predict for sterilisation of pelvic lymph nodes, a low risk of local reccurence and appropriateness of local excision? Int J Colorectal Dis 2006;21 : 11−7.
26. Glynne-Jones R, Wallace M, Livingstone JIL, et al. Complete clinical response after chemoradiation in rectal cancer: is a “wait and see“ policy justified? Dis Col Rectum 2008;51 : 10−9.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Pruritus aniČlánek XV. Bedrnův den
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2015 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Karcinom rekta. Zářit více nebo méně?
- Pruritus ani
- Profesor Čapov oslavil 60. jubileum
- Současný stav strategie léčby karcinomu rekta v České republice s ohledem na výskyt kompletní patologické odpovědi při neoadjuvantní léčbě – studie PATOD C20 2011–2012
- Magnetická detekce sentinelových uzlin u karcinomu prsu metodou SentiMag
- Akutní krvácení do zažívacího traktu – skutečně chirurgická diagnóza?
- Kritické komplikace specifického střevního zánětu − kazuistika
- Endoskopické endonazální ošetření nasální likvorey při zlomenině klivu – kazuistika
- Heterotopická mezenteriálna osifikácia
- XV. Bedrnův den
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pruritus ani
- Magnetická detekce sentinelových uzlin u karcinomu prsu metodou SentiMag
- Heterotopická mezenteriálna osifikácia
- Endoskopické endonazální ošetření nasální likvorey při zlomenině klivu – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



