-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neúspěšná lymfoscintigrafie před sentinelovou biopsií u karcinomu prsu, možné příčiny a důsledky pro chirurgický výkon – analýza výsledků 3014 vyšetření
Failed preoperative lymphoscintigraphy for sentinel lymph node biopsy in breast cancer, possible causes and implications for the surgery – the analysis of 3014 procedures
Introduction:
The aim of the study was to review the cases of sentinel lymph node biopsy for breast cancer in which preoperative lymphoscintigraphy had shown no axillary hot spot; to assess the frequency of failed examinations and possible causes of the failure; to analyze subsequent surgical procedures and hence to provide a general recommendation on what to do in such a situation.Methods:
A retrospective overview of 3014 lymphoscintigraphy examinations at the Masaryk Memorial Cancer Institute from 2001 to 2011 with a more detailed analysis of the cases with axillary hot spot visualization failure.Results:
The axillary hot spot was not shown in 71 examinations (2.4%). The frequency of failed lymphoscintigraphy during the time period did not change substantially. The possible risk factors of failed lymphoscintigraphy include: previous surgery on the breast or the axilla, obturation of the lymphatic drainage with the cancer, and the absence of the tracer injection site massage. The most common surgical procedures to respond to a failed examination were: the application of patent blue and surgical exploration of the axilla, no axillary surgery, or axillary dissection.Conclusion:
When repeated scanning with the gamma camera through the first several hours is performed, the frequency of failed lymphoscintigraphy procedures remains very low (2.4%). If there is no axillary hot spot shown, patent blue is to be injected and the axilla should be surgically explored. This solution will be successful in most patients. If the sentinel lymph node cannot be detected even using the combined method, the surgical procedure needs to be selected with regard to the individual clinical context.Key words:
breast cancer – sentinel lymph node – sentinel lymph node biopsy – lymphoscintigraphy – failed detection
Autoři: O. Coufal 1,2
; O. Zapletal 1; P. Vrtělová 1; J. Vašina 3; Z. Řehák 2,3
Působiště autorů: Oddělení chirurgické onkologie, Masarykův onkologický ústav, primář: MUDr. V. Chrenko, CSc. 1; Klinika komplexní onkologické péče, Lékařská fakulta Masarykovy univerzity přednosta: prof. MUDr. R. Vyzula, CSc. 2; Oddělení nukleární medicíny, Masarykův onkologický ústav, primář: MUDr. Z. Řehák, Ph. D. 3
Vyšlo v časopise: Rozhl. Chir., 2015, roč. 94, č. 3, s. 126-130.
Kategorie: Původní práce
Souhrn
Úvod:
Cílem práce bylo zjistit četnost lymfoscintigrafických (LSG) vyšetření k detekci sentinelové uzliny u karcinomu prsu na našem pracovišti, při nichž nedošlo k zobrazení axilárního horkého ložiska, odhadnout možné faktory, které se na neúspěchu vyšetření mohou podílet, zjistit reakce operatérů na zmíněnou situaci a formulovat obecné doporučení, jak při neúspěšném LSG vyšetření postupovat.Metody:
Retrospektivní zhlédnutí výsledku 3014 LSG vyšetření provedených na našem pracovišti v letech 2001–2011 a bližší rozbor případů, kdy nedošlo k zobrazení axilárního horkého ložiska.Výsledky:
K zobrazení horkého ložiska v axile nedošlo celkem v 71 případě (2,4 %). Četnost neúspěšných vyšetření se dlouhodobě příliš nemění. Rizikový faktor představuje především předchozí chirurgický výkon na prsu nebo v axile, nádorová obturace lymfatické drenáže a absence masáže místa aplikace indikátoru. Operatéři na neúspěch LSG vyšetření reagovali nejčastěji aplikací barviva a explorací axily, vynecháním zákroku na uzlinách, případně axilární disekcí.Závěr:
Používáme-li při lymfoscintigrafickém vyšetření opakované snímání po delší dobu, je četnost neúspěšných vyšetření velmi malá (2,4 %). Nezobrazí-li se v axile depo aktivity, doporučujeme použít vitální barvení a chirurgicky explorovat axilu. U většiny pacientů bývá tento postup úspěšný. Pokud se identifikace SN nezdaří ani kombinovanou metodou, je nutno zvolit chirurgický výkon dle individuálního vyhodnocení klinického kontextu.Klíčová slova:
karcinom prsu – sentinelová uzlina – biopsie sentinelové uzliny – lymfoscintigrafické vyšetření – neúspěšná detekceÚvod
Biopsie sentinelové uzliny (SNB) začala u karcinomu prsu pronikat do klinické praxe před 20 lety [1], v České republice přibližně o 5 let později [2,3]. Od roku 2010 je již zcela jednoznačným výkonem první volby u pacientek bez klinických známek uzlinových metastáz [4]. K detekci sentinelové uzliny (SN) se většinou užívá lymfoscintigrafického (LSG) vyšetření s peroperační identifikací uzliny příruční gamma sondou, případně metody kombinované, kdy je aplikace radioaktivně značeného indikátoru (radiokoloidu) doplněna vitálním barvením, nejčastěji pomocí patentní modři. V typickém případě je výsledkem scintigrafického vyšetření „horké“ ložisko ve stejnostranné axile podmíněné hromaděním radioaktivního indikátoru v axilární SN.
V praxi se však někdy setkáváme se situací, kdy se horké ložisko v axile nezobrazí. Tuto situaci označíme pro účely tohoto článku jako „neúspěšné LSG vyšetření“. Pro operujícího chirurga tím vzniká složitá situace, neboť neexistuje jednoznačné a všeobecně přijímané doporučení, jak v takových případech postupovat.
Cílem naší práce bylo zjistit četnost neúspěšných LSG vyšetření v naší klinické praxi a odhadnout možné faktory, které se na neúspěchu vyšetření mohou podílet. Dále zjistit reakce operujících chirurgů na zmíněnou situaci a možné důsledky pro operované pacienty. Na základě zjištěných údajů a literárních dat pak formulovat doporučení, jak při neúspěšném LSG vyšetření při chirurgickém výkonu nejlépe postupovat.
Metody
Z běžné zdravotnické databáze našeho pracoviště byly retrospektivně vyhledány popisy všech LSG vyšetření k předoperační detekci SN u pacientů s karcinomem prsu v období let 2001–2011. Vyšetření probíhala formou jednodenního protokolu, jako radioindikátor byl používán 99mTc Nanocoll, aplikovaná dávka zpravidla 100 MBq. Po aplikaci 1 ml radioindikátoru a krátkodobé masáži místa aplikace je pacient snímán pomocí gamma kamery a průmět zaznamenaného depa aktivity označen křížkem na kůži. Případy, kdy nedošlo k zobrazení horkého ložiska v axile, byly dle dostupné dokumentace (retrospektivně) blíže rozebrány z hlediska místa aplikace radiokoloidu, možných příčin neúspěchu LSG vyšetření, chirurgického postupu, výsledku histologického vyšetření, axilárního relapsu a případných dalších významných klinických skutečností.
Výsledky
Ve sledovaném období bylo v dané indikaci provedeno 3013 LSG vyšetření. K zobrazení horkého ložiska v axile nedošlo celkem v 71 případech (2,4 %). Počty vyšetření v jednotlivých kalendářních letech jsou uvedeny v Tab. 1.
Tab. 1. Lymfoscintigrafická vyšetření (včetně neúspěšných) v jednotlivých letech Tab. 1. Lymphoscintigraphy examinations (including failures) in calendar years 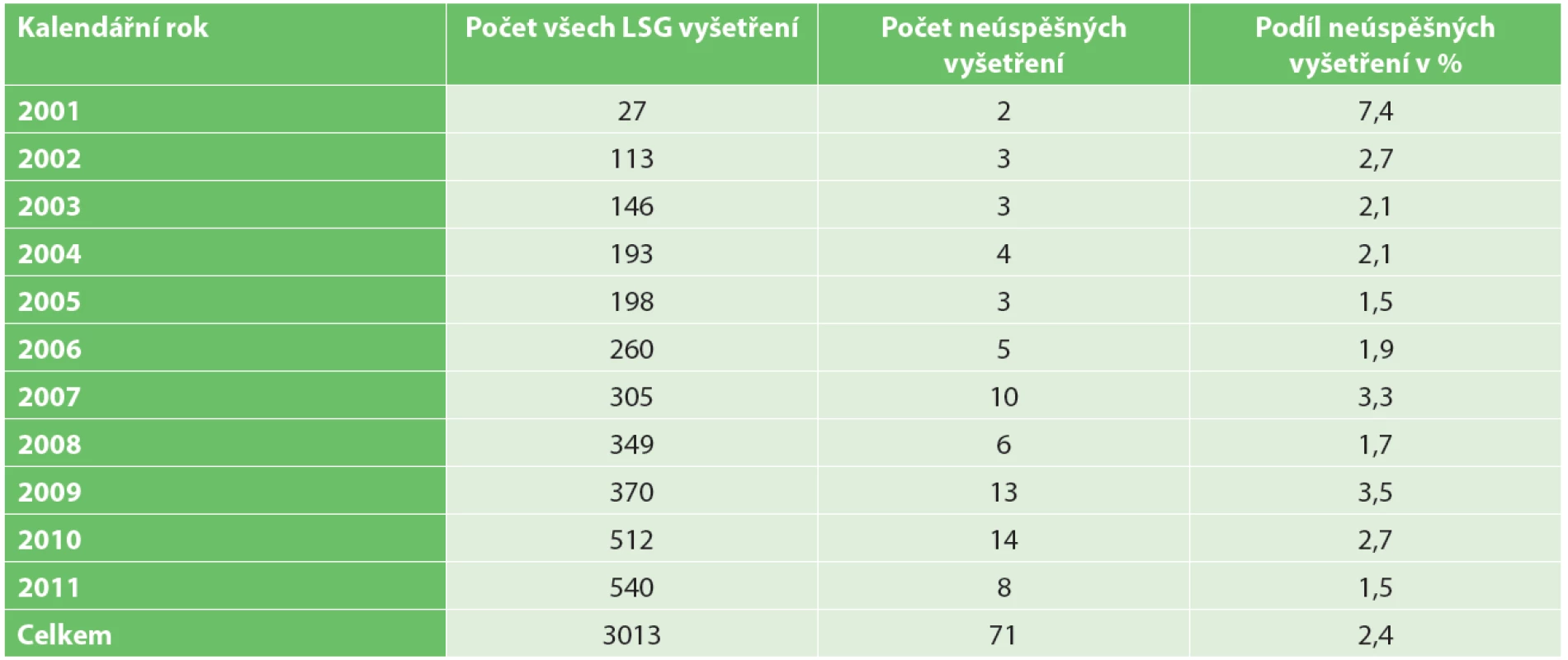
Ve skupině pacientů (resp. pacientek, neboť se jednalo výhradně o ženy) s neúspěšným LSG vyšetřením bylo zastoupení primárních nádorů (dle cTNM klasifikace) následující: 14x Tis, 43x T1, 11x T2, 1x T3, 1x T4 a 1x nebylo stadium před operací stanoveno z důvodu diagnostické nejistoty, později se však ukázalo, že šlo o difúzní karcinom se známkami nádorové „inflamace“ s masivně postiženými uzlinami (T4d). Ze zmíněných nádorů bylo 63 primárních, 8 lokálních recidiv. Většinou šlo o nepředléčené pacientky, kdy operace na uzlinách probíhala současně s operací primárního nádoru. Jedna pacientka byla operována po neadjuvantní chemoterapii, v jednom případě se jednalo o ženu, které byl již nádor dříve chirurgicky odstraněn, a sentinelová biopsie byla doplňována v druhé době. Jedenkrát šlo o tzv. „premastectomy SNB“, tedy o SNB jako samostatnou operaci před zamýšlenou mastektomií s okamžitou rekonstrukcí na spolupracujícím pracovišti. Radiokoloid byl aplikován intraparenchymatózně do blízkosti primárního nádoru (nebo jizvy) ve 47 případech, nebo periareolárně ve 24 případech. Výkonem na prsu byla u 57 pacientek parciální mastektomie, 14x totální mastektomie.
Faktory, které zvyšují pravděpodobnost neúspěchu LSG vyšetření, nelze námi zvolenou metodikou objektivně posoudit, můžeme je však na základě dostupných údajů odhadnout či předpokládat a uvádíme je v Tab. 2.
Tab. 2. Možné faktory přispívající k neúspěchu lymfoscintigrafického vyšetření Tab. 2. Possible causes of lymphoscintigraphy examination failure 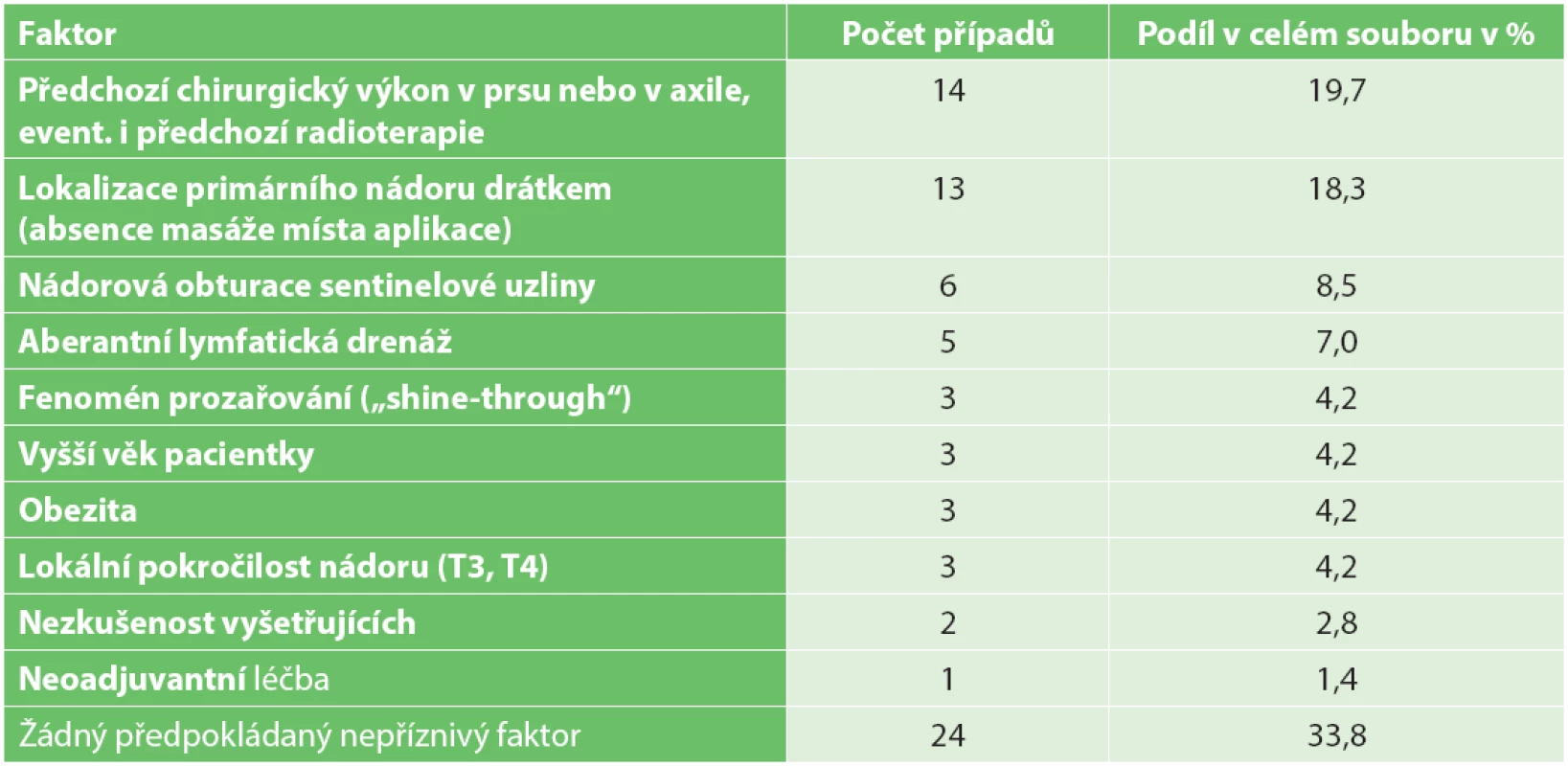
Postupy operatérů po neúspěšném LSG vyšetření lze rozdělit do následujících skupin:
Aplikace patentní modři a explorace axily (42 případů)
Ve 42 případech řešil operatér situaci tak, že aplikoval patentní modř a chirurgicky exploroval axilu. Celkem 35krát (83,3 %) se pomocí barviva podařilo axilární sentinelovou uzlinu identifikovat a exstirpovat; z toho v 5 případech byla makroskopicky suspektní, kryobiopsií potvrzena její metastatická infiltrace a ihned doplněna disekce axily. V těchto případech lze předpokládat, že důvodem neúspěchu LSG vyšetření byla nádorová obturace SN. Z ostatních 30 případů byla dodatečně při definitivním histopatologickém vyšetření nalezena 3x metastáza, 2x mikrometastáza a 1x izolované nádorové buňky (ITC). 24x byla sentinelová uzlina zcela negativní. Mezi 7 případy, kdy nepomohla ani aplikace barviva, byla 5x provedena disekce axily (3x uzliny s metastázami, 2x bez metastáz), 1x limitovaná disekce kaudální části axily a 1x nebyl doplňován žádný další zákrok na uzlinách, neboť pacientka s případnou disekcí předem výslovně nesouhlasila. Při histopatologickém vyšetření výše uvedeného disekátu kaudální části axily nebyly nalezeny žádné lymfatické uzliny, přesto však nebyl další zákrok doplňován, neboť šlo o tumor relativně příznivých biologických vlastností.
Vynechání výkonu na uzlinách (13 případů)
Ve 13 případech bylo na základě neúspěšného LSG vyšetření od výkonu na uzlinách v první době ustoupeno, byl resekován jen primární nádor. Nutno zmínit, že z těchto 13 případů se dle punkční biopsie 9x jednalo pouze o preinvazivní stadium (DCIS), kdy indikace výkonu na uzlinách byla pouze relativní. 3x šlo o invazivní nádor biologicky příznivých charakteristik a 1x o pacientku, která s disekcí axily předem výslovně nesouhlasila. Po obdržení výsledku definitivní histologie bylo 10x rozhodnuto, že axilární „staging“ být doplněn nemusí (9x DCIS, 1x invazivní karcinom příznivého fenotypu u pacientky vysokého věku). Ve 3 případech bylo doporučeno výkon na uzlinách dodatečně doplnit. Z uvedených 3 opakovaných LSG vyšetření bylo jedno úspěšné a SNB byla bez problému doplněna. Ve 2 případech se identifikace SNB nezdařila ani opakovaně, tedy byla disekována axila. Ve všech třech uvedených případech byly doplňované operaceodstraněné uzliny histologicky negativní.
Disekce axily z důvodu neúspěšné identifikace SN (11 případů)
V 11 případech byla po nezobrazení horkého ložiska primárně disekována axila, aniž bylo použito vitální barvení. Z toho 8x (72,7 %) byly uzliny histopatologicky negativní. 2x byly v disekátu nalezeny menší (mikro)metastázy a v jednom případě bylo nádorově postiženo všech 14 odstraněných uzlin; zde tedy lze předpokládat, že důvodem neúspěchu LSG vyšetření byla nádorová obturace lymfatického drenážního systému.
Exstirpace pouze extraaxilární SN, bez explorace axily (4 případy)
4x se operatér rozhodl explorovat pouze parasternální oblast, kde bylo dle LSG vyšetření nalezeno depo aktivity. Ve všech 4 případech byla parasternální SNB zdánlivě úspěšná, 3x se jednalo o histologicky negativní drobnou uzlinu, 1x však patolog při vyšetření domnělé SN nalezl pouze tukovou tkáň, bez přítomnosti lymfatické uzliny. Při následující onkologické rozvaze byly první 3 pacientky považovány za N0 (bez uzlinových metastáz), u čtvrté pacientky se i přes neznalost histopatologického stavu uzlin další operace nedoplňovala, jednalo se o malý nádor příznivého fenotypu u pacientky vyššího věku.
Explorace axily bez aplikace barviva (1 případ)
U jedné pacientky vyššího věku (82 let v době operace) se operatér rozhodl exstirpovat z axily jen jednu hmatnou zvětšenou uzlinu. Histologicky v ní byla nalezena objemná metastáza. Vzhledem ke klinickým okolnostem (vysoký věk, chůze o berlích, nádor fenotypu luminal A) však nebyla doplněna disekce axily, pacientka absolvovala radioterapii, probíhá adjuvantní hormonální léčba. Pacientky je nyní, téměř 4 roky po operaci, klinicky bez známek nádorového onemocnění.
Zajímavostí je, že jedna pacientka ve sledovaném souboru je hodnocena jako 2 případy. Poprvé řešil operatér situaci vitálním barvením a nalezl jednu SN, histologicky negativní. Po 3 letech byla pacientka operována pro lokální recidivu v prsu, při LSG vyšetření se ložisko v axile opět nezobrazilo. Stejný operatér řešil situaci axilární disekcí, kdy byly ve dvou uzlinách nalezeny mikrometastázy. Předpokládaným důvodem neúspěchu prvního LSG vyšetření byla obezita pacientky, ve druhém případě se mohl spolupodílet i vliv předchozího chirurgických výkonů a radioterapie.
U žádné pacientky z hodnoceného souboru nedošlo dosud, dle dostupných dat, k regionálnímu relapsu v axilárních uzlinách. Kvalita údajů z dlouhodobého sledování je však omezená, přiměřená běžné klinické praxi.
Diskuze
Četnost LSG vyšetření, kdy se nezobrazí depo radioaktivity v axile, byla v našem souboru pouhých 2,4 %. To je výrazně méně než ve většině dosud publikovaných studií na toto téma [5−9]. Nízkou četnost si vysvětlujeme rozdílnou metodikou vyšetření na různých pracovištích. Pokud nedojde při prvním snímání 20−30 minut po aplikaci indikátoru k zobrazení horkého ložiska, vyšetření neukončujeme, ale snímáme opakovaně, 60 a 120 minut od aplikace. Často se depo aktivity zobrazí až s výraznějším časovým odstupem.
Co se týká vývoje úspěšnosti LSG vyšetření v čase („learning curve“), v prvním roce jsme zaznamenali lehce vyšší podíl neúspěšných vyšetření (7,4 %). Jedná se o dva případy, kdy k neúspěchu vyšetření mohla přispět jistá nezkušenost s postupem, nejspíše snaha o aplikaci bezprostředně k primárnímu nádoru, což mohlo vést k nežádoucí aplikaci přímo do něj. Ale může jít i o chybu malých čísel. V dalších letech se četnost neúspěšných vyšetření drží stabilně na nízkých hodnotách. Výrazněji se neprojevila ani změna metodiky v roce 2009, kdy jsme od intraparenchymatózní aplikace indikátoru do blízkosti primárního nádoru přešli k aplikaci periareolární, do kvadrantu, kde se primární nádor nachází. Z periareolární oblasti je, dle literatury [10] i vlastních zkušeností, výraznější lymfatická drenáž, a tedy obecně vyšší pravděpodobnost zobrazení sentinelové uzliny.
Možné faktory přispívající k absenci axilárního horkého ložiska nebylo možno námi zvolenou metodikou objektivně posoudit. Můžeme je jen odhadovat na základě orientačního posouzení četnosti specifických situací v našem souboru v souladu s literárními údaji. Nepřekvapuje poměrně vysoké zastoupení pacientek s předchozími chirurgickými výkony v oblasti prsu nebo axily, které nepochybně mohou lymfatický odtok přerušit. Logicky se nabízí i možnost nádorové obturace sentinelové uzliny, což odpovídá zvýšené četnosti neúspěšných LSG vyšetření u pacientek s rozsáhlejším metastatickým postižením axily [5,7−9]. Zde je potřeba zdůraznit nutnost pečlivé palpační explorace axily při sentinelové biopsii, i každá palpačně suspektní uzlina musí být při sentinelové biopsii odstraněna [11]. Odhadem se domníváme, že i faktor lokalizace primárního nádoru drátěným vodičem, namísto lokalizace křížkem na kůži, která je v naší praxi nepoměrně častější, může zvyšovat riziko neúspěchu LSG vyšetření. Při lokalizaci drátkem totiž místo aplikace nemasírujeme pro obavu z dislokace drátku. Je pravděpodobné, že „masáž“ urychluje lymfatický odtok a zvyšuje pravděpodobnost úspěšné detekce SN. U některých pacientů je zřejmě přítomna aberantní lymfatická drenáž, tj. situace, kdy je oblast prsu dominantně drénována do extraaxilární oblasti. Literárně udávaný negativní vliv vyššího věku nebo obezity na úspěšnost zobrazení horkého ložiska nemůžeme na základě našich dat či empirických zkušeností označit jako zásadní.
Zamyšlení zasluhuje analýza případů, jak postupovali operatéři při chirurgickém výkonu. V naší praxi jsme nikdy nepoužili postup popisovaný v literatuře spočívající v opakované aplikaci radioaktivního nosiče [8,12]. Naši operatéři nejčastěji volili aplikaci patentblau s chirurgickou explorací axily. Vidíme, že tento postup má velkou naději na úspěch (83,3 %). V některých případech vykazuje nalezená sentinelová uzlina i menší radioaktivitu, která nebyla zaznamenána při lymfoscintigrafii, ale lze ji detektovat gamma sondou bezprostředně přiloženou k uzlině. Pokud se ani pomocí barviva a chirurgické explorace axily nedaří axilární uzlinu nalézt, nutno individuálně zvážit klinický kontext. Na výběr máme především mezi ustoupením od výkonu na uzlinách a primární axilární disekcí. Na výkon na uzlinách lze rezignovat tehdy, pokud se jedná pouze o DCIS (dle punkční biopsie) [13,14], nebo o menší nádor vysloveně příznivých biologických charakteristik. Případně v situacích, kdy pacientka s disekcí axily předem výslovně nesouhlasila. Axilární „staging“ je možné zopakovat dodatečně, pokud je nález po histopatologickém vyšetření resekátu vyhodnocen jako závažnější. Disekce axily bývá sice v případě neúspěchu identifikace SN běžně doporučována, musíme si však být vědomi rizika zbytečného poškození pacientky sekundárním lymfedémem nebo jinými komplikacemi. Tzv. „disekce kaudální části axily“, popsaná v našem souboru, se nejevila příliš účelně, neboť při histopatologickém vyšetření nebyly žádné uzliny nalezeny. Reálnou možností je axilární sampling [15], tzn. necílené odstranění minimálně 4 lymfatických uzlin z oblasti Sorgiusovy uzliny, k němuž však žádný operatér v našem souboru nesáhl.
Další možnosti chirurgického řešení, které jsme v našem souboru také zaznamenali, nepovažujeme za příliš vhodné. Ve skupině 11 axilárních disekcí bez snahy o vitální barvení lze minimálně v 8 případech považovat disekci z dnešního pohledu za zbytečnou (pN0). Nezdá se nám ani vhodné explorovat pouze extraaxilární oblast, neboť stav extraaxilárních regionálních uzlin, resp. jeho důsledky pro volbu adjuvantní léčby nejsou příliš průkazné a zůstávají i v dnešní době kontroverzní [16]. Tu a tam se jistě vyskytne případ, který je nutno posoudit individuálně a může být řešen zcela neobvykle, jako tomu bylo i v našem souboru – konkrétně exstirpace jedné zvětšené uzliny, kdy i přes nález objemné makrometastázy nebyla doplněna axilární disekce vzhledem ke klinickým okolnostem, a to se jednalo o dobu před zohledněním závěrů studie ACOSOG Z0011 do naší praxe [17].
Závěr
Používáme-li při lymfoscintigrafickém vyšetření opakovaného snímání po delší dobu, je četnost neúspěšných vyšetření, kdy se v axile nezobrazí depo aktivity, velmi malá (2,4 %). Situace spojené s vyšším rizikem neúspěchu vyšetření zahrnují předchozí chirurgické výkony na prsu nebo v axile, nádorovou obturaci lymfatické drenáže a absenci masáže místa aplikace, např. z důvodu obav z dislokace lokalizačního drátku. Roli však mohou hrát i habituální či jiné faktory, které není snadné předem prokázat či odhadnout.
Nezobrazí-li se v axile depo aktivity, doporučujeme použít vitální barvení (např. aplikace patentní modři) a chirurgicky explorovat axilu. U většiny pacientů bývá tento postup úspěšný. Pokud se identifikace SN nezdaří ani kombinovanou metodou, je nutno zvolit chirurgický výkon dle individuálního vyhodnocení klinického kontextu.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101) a MZ ČR – RVO (MOÚ, 00209805).
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Oldřich Coufal, Ph.D.
Komenského 481
691 64 Nosislav
e-mail: oldrich.coufal@gmail.com
Zdroje
1. Veronesi U, Paganelli G, Galimberti V, et al. Sentinel-node biopsy to avoid axillary dissection in breast cancer with clinically negative lymph-nodes. Lancet 1997;349 : 1864−7.
2. Gatěk J, Duben J, Dudešek B, et al. Sentinelová uzlina u karcinomu prsu. Rozhl Chir 2000;79 : 77−80.
3. Gatěk J, Hnátek L, Dudešek B, et al. Biopsie sentinelové uzliny u karcinomu prsu v klinické praxi. Rozhl Chir 2008;87 : 180−5.
4. Krag DN, Anderson SJ, Julian TB, et al. Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings form the NSABP B-32 randomised phase 3 trial. Lancet Oncol 2010;11 : 927−33.
5. Brenot-Rossi I, Houvenaeghel G, Jacquemier J, et al. Nonvisualization of axillary sentinel node during lymphoscintigraphy: is there a pathologic significance in breast cancer? J Nucl Med 2003;44 : 1232−7.
6. Rousseau C, Classe JM, Campion L, et al. The impact of nonvisualization of sentinel nodes on lymphoscintigraphy in breast cancer. Ann Surg Oncol 2005;12 : 533−8.
7. Lo YF, Hsueh S, Ma SY, et al. Clinical relevance of nonvisualized sentinel lymph nodes in unselected breast cancer patients during lymphoscintigraphy. Chang Gung Med J 2005;28 : 378−86.
8. Heuts EM, van der Ent FW, van der Pol HA, et al. Additional tracer injection to improve the technical success rate of lymphoscintigraphy for sentinel node biopsy in breast cancer. Ann Surg Oncol 2009;16 : 1156−63.
9. Abdollahi A, Jangjoo A, Dabbagh Kakhki VR, et al. Factors affecting sentinel lymph node detection failure in breast cancer patients using intradermal injection of the tracer. Rev Esp Med Nucl 2010;29 : 73−7.
10. Fowler JC, Solanki CK, Ballinger JR, et al. Axillary lymph node drainage pathways from intradermal and intraparenchymal breast planes. J Surg Res 2010;161 : 69−75.
11. Coufal O, Fait V. Biopsie sentinelové uzliny. In: Coufal O, Fait V a kol. Chirurgická léčba karcinomu prsu. Praha, Grada Publishing, 2011 : 207−25.
12. Meretoja TJ, Joensuu H, Heikkilä PS, et al. Safety of sentinel node biopsy in breast cancer patients who receive a second radioisotope injection after visualization failure in lymphoscintigraphy. J Surg Oncol 2010;102 : 649−55.
13. Chvalný P, Donát R, Dyttert D, et al. DCIS a biopsia sentinelovej uzliny. Rozhl Chir 2011;90 : 352−60.
14. Mergancová J, Mergancová J, Hrnčířová I, et al. Vyšetření sentinelové uzliny u in situ karcinomu prsu. Rozhl. Chir 2011;90 : 393−6.
15. Chetty U, Chin PK, Soon PH, et al. Combination blue dye sentinel lymph node biopsy and axillary node sampling: the Edinburgh experience. Eur J Surg Oncol 2008;34 : 13−6.
16. Wouters MW1, van Geel AN, Menke-Pluijmers M, et al. Should internal mammary chain (IMC) sentinel node biopsy be performed? Outcome in 90 consecutive non-biopsied patients with a positive IMC scintigraphy. Breast 2008;17 : 152−8.
17. Krsička P, Coufal O, Zapletal O. Pozitivní sentinelová uzlina u karcinomu prsu – kdy a proč doplňovat axilární disekci? Rozhl Chir 2013;92 : 684−9.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Chirurg a noblesa
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2015 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Role chirurgické embolektomie arteria pulmonalis a membránové mimotělní oxygenoterapie v léčbě masivní plicní embolie – přehled
- K devadesátým narozeninám profesora Vladimíra Nahodila
- Možnosti korekcie recidívy pectus excavatum u dospelých pacientov a adolescentov
- Vynechání disekce axily u karcinomu prsu při pozitivní sentinelové uzlině – pilotní studie
- Neúspěšná lymfoscintigrafie před sentinelovou biopsií u karcinomu prsu, možné příčiny a důsledky pro chirurgický výkon – analýza výsledků 3014 vyšetření
- Pozdní vznik hematomu jater po deceleračním traumatu
- První retransplantace plic v České republice
- Přednáška profesora M. W. Büchlera v Praze
- Chirurg a noblesa
- Funkční poruchy po resekci rekta
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Funkční poruchy po resekci rekta
- Možnosti korekcie recidívy pectus excavatum u dospelých pacientov a adolescentov
- Vynechání disekce axily u karcinomu prsu při pozitivní sentinelové uzlině – pilotní studie
- Pozdní vznik hematomu jater po deceleračním traumatu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



