-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Karcinom žaludečního pahýlu – unicentrická analýza 7 pacientů
Gastric stump cancer – unicentric analysis of 7 patients
Introduction:
Gastric stump cancer accounts for 1−4% of all gastric carcinomas. Originally this term included patients who previously underwent surgery due to peptic ulcer disease but today gastric stump cancer also includes patients diagnosed some time after primary gastric resection due to gastric cancer. The incidence is increasing. Gastric stump cancer is associated with poor prognosis and its reported resecability is around 40%.Methods:
We retrospectively analyzed the data of 7 patients with a preoperatively histologically confirmed stump cancer who had been operated at the Department of Surgery at Nový Jičín Hospital during 2006−2014.Results:
We operated 5 men and 2 women with the median age of 70 years (55−80). The primary surgical resection in all our patients was BII gastric resection due to peptic ulcer disease, and GSC had evolved within a median of 38 years (32−46) after primary intervention. None of the patients had been regularly screened by endoscopy following primary surgery. We performed five curative resections (four total gastrectomies, one subtotal gastrectomy). Our resecability rate was 71%. In two cases, only explorative laparotomy was performed due to generalisation of the malignancy. Two patients from the resected group died after 30 and 34 months due to progression of their disease; the other three patients are still alive after 17, 19 and 88 months.Conclusion:
Gastric stump cancer is a malignancy often diagnosed in its late stages. Regural endoscopic screening after primary gastric resection for benign disease can lead to diagnosis at an earlier stage, thereby improving the resection rate and overall survival. This also applies to long-term follow-up of patients with primary subtotal gastrectomy for cancer. Lymphatic metastasizing of the carcinoma can often be different due to the previous surgical intervention and altered anatomy. This must be taken into account during operations.Key words:
gastric stump cancer – surgical treatment – endoscopic screening
Autoři: T. Jínek 1; L. Adamčík 1; M. Duda 1,2; M. Škrovina 1,3
Působiště autorů: Chirurgické oddělení Nemocnice Nový Jičín, a. s., Centrum vysoce specializované onkologické péče pro dospělé Nový Jičín primář: MUDr. M. Škrovina, Ph. D. 1; II. chirurgická klinika LF UP Olomouc přednosta: prof. MUDr. P. Bachleda, CSc. 2; I. chirurgická klinika LF UP Olomouc přednosta: prof. MUDr. Č. Neoral, CSc. 3
Vyšlo v časopise: Rozhl. Chir., 2015, roč. 94, č. 9, s. 362-366.
Kategorie: Původní práce
Souhrn
Úvod:
Frekvence karcinomu žaludečního pahýlu je uváděna u 1–4 % všech karcinomů žaludku. Původně tento termín zahrnoval nemocné operované pro vředovou chorobu gastroduodena, ale dnes může zahrnovat i pacienty po primární operaci pro malignitu v delším časovém odstupu od primární operace. Jeho incidence vzrůstá. Karcinom žaludečního pahýlu je dlouhodobě brán jako nádorové onemocnění se špatnou prognózou, jehož resekabilita se udává kolem 40 %.Metody:
Retrospektivně byla analyzována data 7 operovaných s předoperačně histologicky verifikovaným pahýlovým karcinomem z období 2006−2014 na chirurgickém oddělení Nemocnice Nový Jičín, a. s.Výsledky:
Bylo operováno 5 mužů a 2 ženy s mediánem věku 70 let (55−80). U všech operovaných byla primární operací BII resekce pro vředovou chorobu a karcinom se vyvinul s mediánem 38 let (32−46). Žádný operovaný nebyl po primární operaci pravidelně endoskopicky sledován. Provedli jsme 5 kurativních resekcí (4x totální gastrektomie, 1x subtotální resekce žaludku). Resekabilita dosáhla 71 %. U 2 nemocných byl výkon ukončen explorativní laparotomií pro generalizaci. Dva resekovaní zemřeli za 30 a 34 měsíců po operaci z důvodů progrese maligního onemocnění, tři žijí v odstupu 17, 19 a 88 měsíců.Závěr:
Karcinom žaludečního pahýlu patří mezi onemocnění diagnostikované v pozdějších stadiích. Pravidelné endoskopické sledování po resekci pro benigní diagnózu může vést ke zjištění většího počtu pacientů v dřívějších stadiích a zlepšit tak resekabilitu a celkové přežívání. Totéž platí i pro dlouhodobé sledování nemocných po subtotální resekci pro karcinom. Vzhledem k předešlé chirurgické intervenci a změněné anatomii je lymfatické metastázování pahýlového karcinomu odlišné, na což musí být brán zřetel při operaci.Klíčová slova:
karcinom žaludečního pahýlu – chirurgická léčba – endoskopický screeningÚVOD
Pahýl žaludku po předchozí resekci je dlouhodobě brán jako rizikový faktor vzniku karcinomu. Udává se, že pacienti po resekci žaludku pro benigní onemocnění mají 4−7 násobné riziko vzniku karcinomu [1]. Karcinom žaludečního pahýlu (GSC gastric stump cancer) představuje 1−4 % všech karcinomů žaludku [2,3,4]. Původně tento termín zahrnoval jen nemocné primárně operované pro vředovou chorobu gastroduodena a poprvé byl popsán Belfourem v roce 1922 [5]. Často byl definován jako karcinom vznikající v pahýlu žaludku po jeho parciální resekci pro benigní onemocnění po více než 5 letech. V posledních letech se koncept pahýlového karcinomu rozšířil o pacienty původně operované pro maligní onemocnění [1,6,7]. Hranice mezi recidivou původního onemocnění a pahýlovým karcinomem není všeobecně přesně stanovena. Japonská společnost pro studium pooperační morbidity po gastrektomii (JSSPMG) tuto hranici stanovila a definovala pahýlový karcinom jako malignitu vznikající po 10 a více letech po parciální resekci žaludku pro benigní i maligní onemocnění [8].
Úspěšnost medikamentózní terapie vředové choroby v 80. letech minulého století vedla k výraznému úbytku žaludečních resekcí pro tuto diagnózu. Časový odstup od těchto posledních operačních zákroků a také větší množství pacientů po subtotálních resekcích pro malignitu vede ke vzrůstající incidenci GSC zejména ve východoasijských zemích [9,10]. GSC je dlouhodobě brán jako nádorové onemocnění se špatnou prognózou, jehož resekabilita se udává kolem 40 % [11]. Krýsl v roce 1976 publikoval pravděpodobně první soubor v tehdejší Československé republice. Popsal 8 pacientů z let 1964−1975 (4 po BI a 4 po BII resekci), u kterých pro pozdní diagnostiku byla provedena šestkrát pouze explorativní laparotomie a u dvou byla založena paliativní gastroenteroanastomóza. Pozdní diagnostiku tehdy vysvětloval obdobnými symptomy, které byly vídány u postgastrických syndromů [12]. V dnešní době však tomu nebývá jinak a 5leté přežívání se udává mezi 7−20 %. Pozdní diagnostika je často spjata s neprováděním pravidelných endoskopických kontrol pahýlu [6,11,13].
V literatuře v souvislosti s tímto onemocněním nalezneme velké množství retrospektivních studií s desítkami pacientů a menší množství multicentrických studií [1,8]. Celkové přežívání pacientů v závislosti na stadiu onemocnění GSC se však neodlišuje od ostatních karcinomů horní třetiny žaludku [11,14,15]. Chirurgická léčba zahrnuje nejčastěji dokončení totální gastrektomie s omentektomií a lymfadenektomií. Resekce žaludku s jeho pozměněnou anatomií a adhezemi může být náročná. V literatuře nacházíme i zmínky o laparoskopických resekcích pro GSC [16]. S rozvojem endoskopických terapeutických metod jsou uváděny případy endoskopické mukózní resekce či submukózní disekce u časného GSC [17,18].
METODA
Retrospektivně byla analyzována data všech operovaných pacientů s předoperačně histologicky verifikovaným pahýlovým karcinomem žaludku na chirurgickém oddělení Nemocnice Nový Jičín, a. s., z období 2006−2014. Byl hodnocen počet let od primární operace, věk pacientů, endoskopické sledování, typ primární rekonstrukce při primoresekci žaludku a umístění karcinomu v oblasti pahýlu. Zhodnocen byl také rozsah resekčního výkonu pro GSC včetně lymfadenektomie a množství disekovaných uzlin. Karcinomy byly zařazeny do stadií dle 7. vydání TNM klasifikace dle UICC (Union for International Cancer Control). Sledováno bylo také přežívání pacientů v závislosti na stádiu onemocnění.
VÝSLEDKY
V letech 2006−2014 bylo na chirurgickém oddělení Nemocnice Nový Jičín, a. s., operováno 293 pacientů s karcinomem žaludku, z toho 7 pacientů s předoperačně histologicky verifikovaným GSC na podkladě doporučení multidisciplinární onkologické komise. Všichni v minulosti podstoupili BII resekci žaludku pro vředovou chorobu a karcinom se vyvinul s mediánem 38 let (32−46) od primární operace. Žádný operovaný nebyl pravidelně endoskopicky sledován a u všech se jednalo o symptomatické onemocnění. V sestavě bylo 5 mužů a 2 ženy s mediánem věku 70 let (55−80). U 5 operovaných byla vykonána kurativní resekce, ve čtyřech případech totální gastrektomie (TG) a v jednom subtotální gastrektomie (STG) u pacienta s karcinomem v anastomóze s objemným žaludečním pahýlem. U všech pacientů byla provedena i omentektomie. U 2 nemocných byl výkon ukončen explorativní laparotomií pro nález karcinózy (Tab. 1). Resekabilita v našem souboru dosáhla 71 %. U 4 pacientů byl karcinom lokalizován do oblasti anastomózy (Obr. 1). Všechny operační výkony byly provedeny otevřeně včetně rozsáhlejší adheziolýzy. U dvou pacientů jsme byli nuceni provést splenektomii (1x pro poranění, 1x pro patologicky zvětšené uzliny ve slezinném hilu).
Lymfadenektomie byla u dvou operovaných provedena v rozsahu D2 a u tří D1+ s odstraněním uzlin při ponechané a. gastrica sinistra a truncus coeliacus. Resekát zahrnoval i část mezenteria jejunální kličky. U jedné pacientky jsme zde nalezli objemnou metastaticky změněnou lymfatickou uzlinu, popsanou již na kontrastním CT v rámci stagingu onemocnění. Pouze u dvou pacientů se podařilo odebrat požadovaný počet uzlin k určení patologické N klasifikace nádoru (oba po D2 lymfadenektomii) (Tab. 2). Medián počtu disekovaných lymfatických uzlin byl 7 (3−25). V perioperačním období jsme nezaznamenali úmrtí. U jednoho pacienta se operační rána hojila per secundam.
Tab. 1. Pacienti operovaní pro karcinom pahýlu žaludku na chirurgickém oddělení Nemocnice Nový Jičín a.s z období 2006−2014 Tab. 1: Summary of all operated patients with gastric stump cancer during 2006−2014 at the Department of Surgery, Nový Jičín Hospital 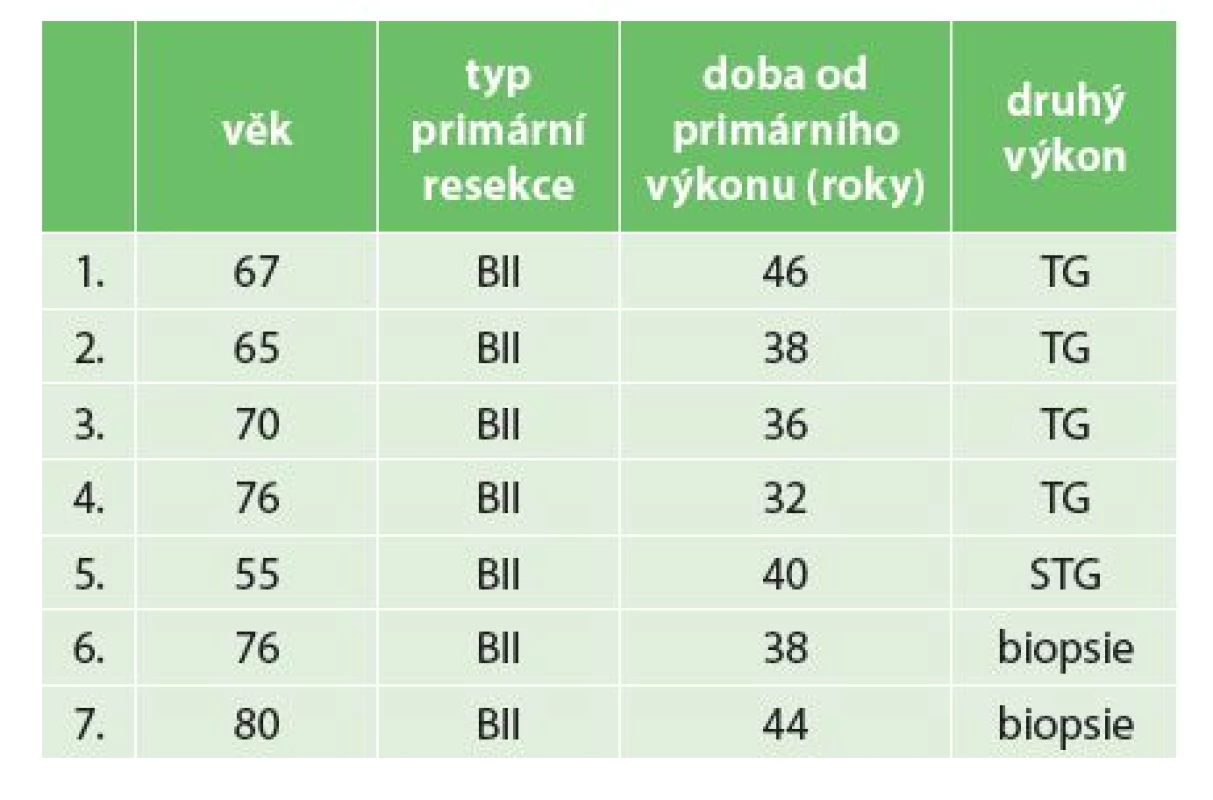
Tab. 2. Shrnutí klinickopatologické charakteristiky, terapie nádorů a přežívání operovaných po primární B2 resekci pro vředovou chorobu na chirurgickém oddělení Nemocnice Nový Jičín a.s. Tab. 2: Summary of clinicopathological features, tumor treatment and overal survival of operated patients after primary BII resection for peptic ulcer disease at the Department of Surgery, Nový Jičín Hospital 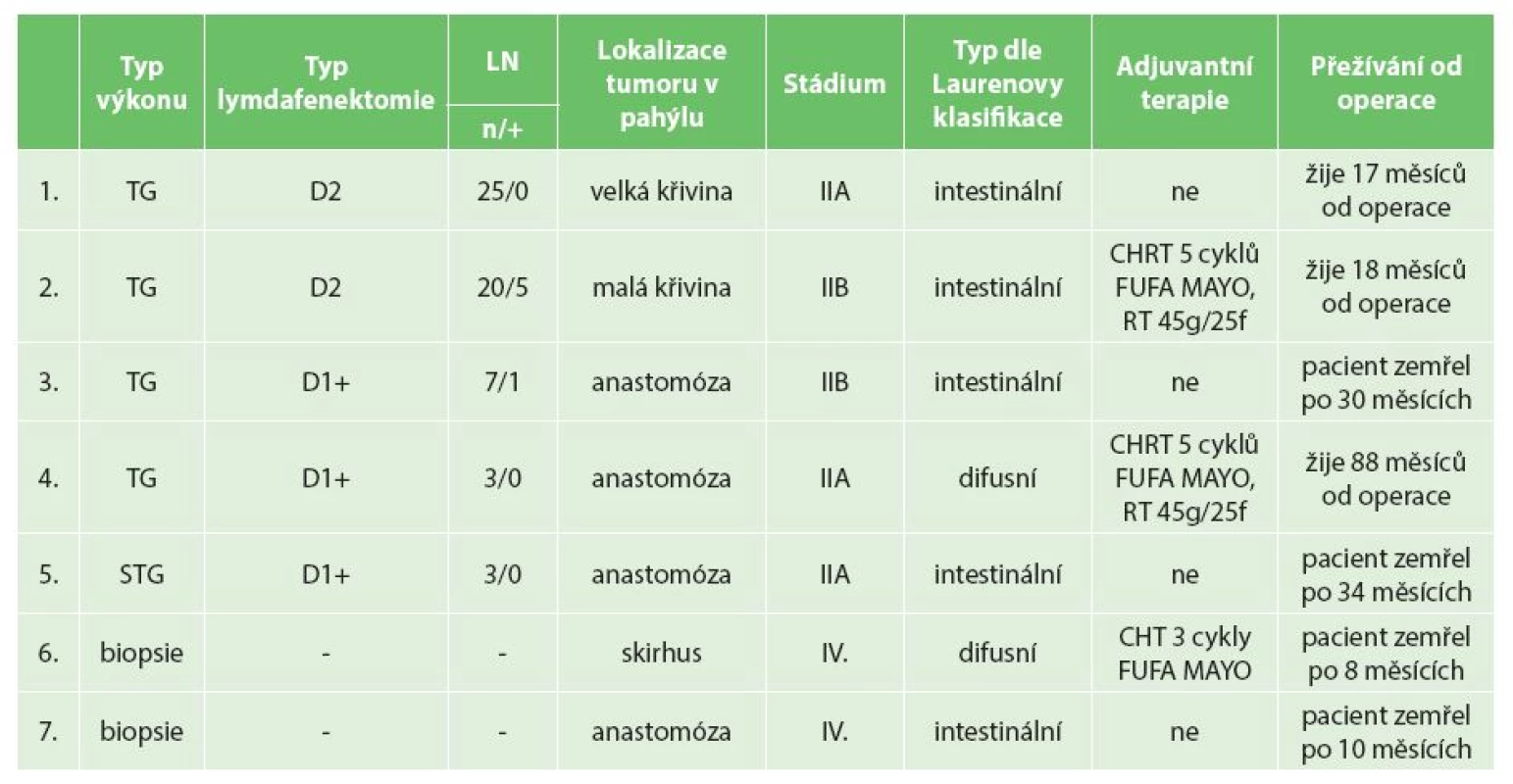
V rámci onkologického sledování dva pacienti ve stadiu IIA přežívají bez známek rekurence onemocnění 17 a 88 měsíců. Další pacient ve stadiu IIA po subtotální gastrektomii s pooperačním komplikovaným hojením operační rány s disekcí malého počtu uzlin s komorbiditami nedospěl k adjuvantní léčbě a zemřel 34 měsíců od operace. Jeden pacient ve stadiu IIB je sledován onkologem bez známek rekurence již 18 měsíců. Pacientka s objemnou metastaticky změněnou mezenteriální uzlinou žila 30 měsíců. Pacienti ve IV. stadiu onemocnění s karcinózou přežívali 8 a 10 měsíců od operační revize.
DISKUZE
Karcinom žaludečního pahýlu nepatří mezi častá onemocnění. Na zvýšené riziko jeho vzniku v žaludečním pahýlu po resekci pro vředové onemocnění poukázali mnozí už v minulém století. Jeho etiopatogeneze není zcela jasná. V literatuře nacházíme pojem GSC zejména u proximálního pahýlu žaludku, nenacházíme však zmínky o karcinomu distálního pahýlu žaludku po proximální resekci. Ačkoliv se GSC může brát jako karcinom proximálního žaludku, zdá se, že jeho karcinogeneze je odlišná. Předpokládá se vliv enterogastrického refluxu s biliopankreatickou šťávou a také vliv hypochlorhydrie po provedené vagotomii. Takto dochází k chronickým zánětlivým změnám sliznice. Zvýšení pH v oblasti pahýlu vede ke kolonizaci anaerobními bakteriemi, které přeměňují nitráty na N-nitrosaminy působící jako karcinogen [1]. Helicobacter pylori je dnes obecně brán jako rizikový faktor podílející se na etiopatogenezi žaludečního karcinomu. Jeho eradikace je doporučována i v případě verifikace v oblasti pahýlu žaludku. Přesný management eradikace, diagnostiky a časování po operaci však není znám. Předpokládá se však, že jeho eradikace není efektivní v prevenci vzniku rekurence vředové choroby a také se nejeví, že jeho infekce je rizikovým faktorem vzniku GSC [19, 20].
Obr. 1. Pahýlový karcinom v oblasti anastomózy 42 let po BII resekci pro benignitu Fig. 1: Gastric stump cancer 42 years after BII resection for benign disease, located at the anastomotic site 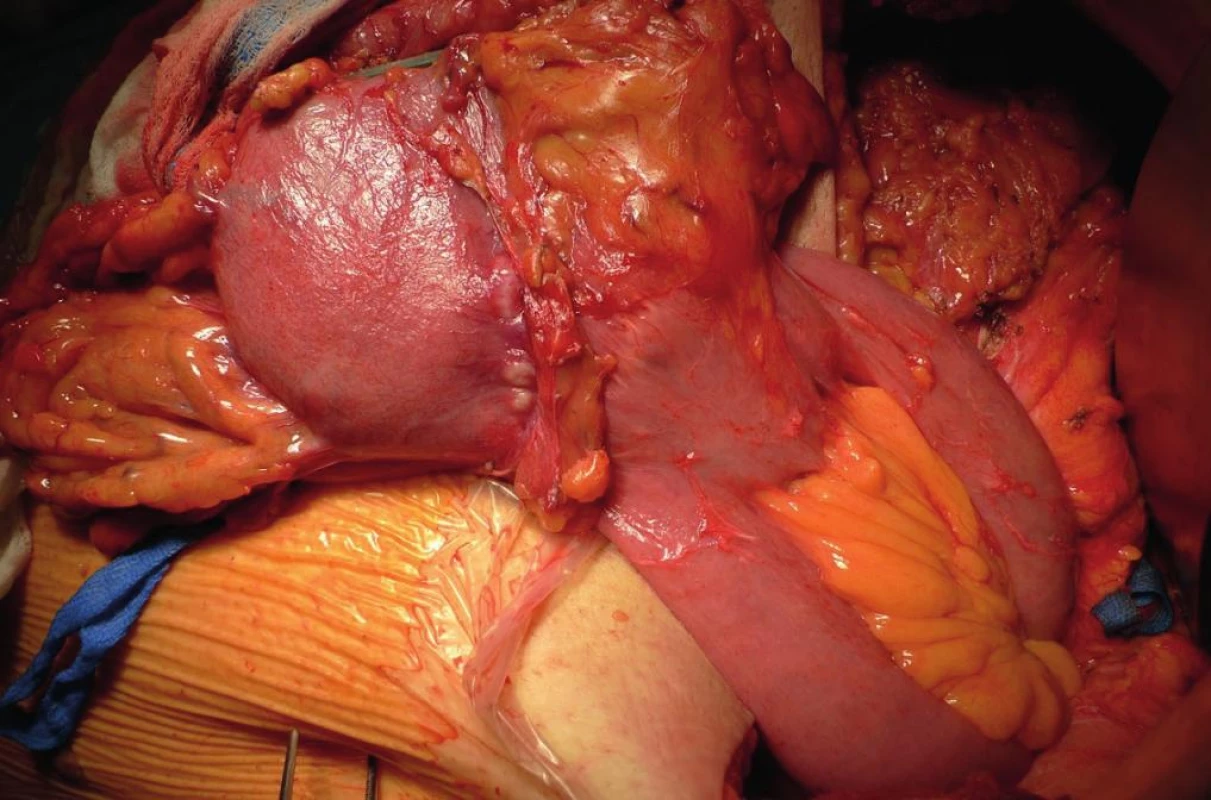
Pravidelné endoskopické sledování pacientů po resekcích žaludku prokázalo, že s odstupem 10−24 let nemá prakticky nikdy sliznice žaludečního pahýlu normální vzhled. Geboes takto prokázal ve svém souboru 56 pravidelně sledovaných pacientů gastritidu, intestinální metaplazii, foveolární hyperplazii a různé stupně dysplazie, které jsou obecně brány jako premaligní stav. Ve svém souboru diagnostikoval 5 pacientů s asymptomatickým infiltrativním karcinomem po 15 a více letech [21]. V našem souboru nebyl žádný pacient po resekci pro vředovou chorobu pravidelně endoskopicky sledován a karcinom byl symptomatický. Pouze dva pacienti s GSC byli diagnostikováni ve IV. stadiu (28,6 %). Obecně se ale udává, že přibližně 50 % pacientů s GSC se diagnostikuje ve stadiu III. a IV. [22]. Časový interval ke vzniku GSC se obecně udává delší u resekcí pro vředovou chorobu. Huang udává interval 25 let od primární resekce pro peptický vřed a 15 let od resekce pro karcinom [23]. Dotazníková multicentrická akce JSSPMG v roce 2008 shromáždila nejrozsáhlejší soubor 887 pacientů s GSC z Japonska, ve kterém obdobné zjištění potvrdila. Po resekci pro benignitu je minimum výskytu GSC po 10−15 letech následováno postupným výrazným zvýšením incidence GSC. U pacientů po primární resekci pro malignitu nalezla maximum GSC v intervalu 10–15 let s exponenciálním snižováním incidence v dalším sledování. Hodnoceny byly však resekce s primární rekonstrukcí BI a BII, avšak rekonstrukce typu Roux Y či jejunální interpozity nebyly zahrnuty [8]. V našem souboru jsme GSC diagnostikovali s mediánem 38 let (32−46 let) od primární intervence pro benignitu. Tumory v pahýlu žaludku po předchozí resekci pro karcinom jsme v našem klinickém materiálu operovali dvakrát a oba nesplnily kritéria pahýlového karcinomu. Odstup od primární operace byl dva a pět let a oba měly rekonstrukci dle Roux Y.
Zatímco nutnost pravidelných endoskopických kontrol k detekci časných asymptomatických GSC je všeobecně akceptována, není konsenzus stran intervalu k započetí sledování a jeho frekvenci. Všeobecně se akceptuje iniciální screening po 10 letech, ale různými autory je doporučen počátek v intervalu 10, 12, 15 a 20 let od resekce pro peptický vřed [24,25]. Další frekvence sledování by měla záviset od důvodu primární resekce a slizničního nálezu na pahýlu žaludku. Největší výskyt karcinomu po BII resekci je udáván v oblasti anastomózy na rozdíl výskytu karcinomu po předchozí BI resekci [8,11,23]. U BII resekcí se to vysvětluje nepřítomností Braunovy omega jejuno-jejunostomie, tedy přítomnosti enterogastrického refluxu. V našem souboru se takto jednalo o 4 pacienty po BII resekcích (57 %). Je však jasné, že na tyto lokality by se měl zaměřit gastroenterolog při pravidelném endoskopickém sledování. K diskuzi je i otázka finančních nákladů pravidelného endoskopického sledování nemocných.
Efekt rekonstrukce po žaludeční resekci na karcinogenezi GSC byl také zkoumán. Takeno prokázal vyšší incidenci a také kratší interval ke vzniku GSC u pacientů po BII resekci ve srovnání s BI resekcí. BI resekce by z těchto důvodů měla být preferována v prevenci GSC [20]. V současné době hojně prováděná rekonstrukce dle Roux Y u resekcí pro karcinom vede k signifikantnímu snížení žlučového refluxu a gastritidě pahýlu žaludku ve srovnání s B1 resekcí [26]. Zatím však nejsou k dispozici relevantní data, která by dokázala nižší incidenci GSC po rekonstrukci dle Roux Y ve srovnání s ostatními rekonstrukcemi.
Klinické pozorování i literární studie poukazují, že GSC má své unikátní lymfatické metastázování, dané anatomickými změnami během první chirurgické intervence [27]. Toto lymfatické šíření karcinomu je dosti pestré. Ve srovnání s typickým karcinomem žaludku byl u GSC po BII resekci nalezen větší výskyt metastatického postižení mezenteria jejuna, a to zejména u pacientů s karcinomem v anastomóze. Toto metastázování se popisuje až u 60 % nemocných v pokročilých stadiích [27,28,29]. V našem souboru jsme metastatické postižení mezenteria diagnostikovali u 1 pacientky již na předléčebném abdominálním CT. Větší výskyt lymfatických metastáz se také popisuje v oblasti slezinného hilu, které jsme také pozorovali u 1 pacienta, u něhož jsme provedli splenektomii. U GSC po BI resekci se častěji nachází metastatické postižení uzlin v oblasti hepatoduodenálního ligamenta a na zadní straně pankreatu (stanice 12 a 13 dle japonské nomenklatury) [29].
Doporučení stran rozsahu chirurgické resekce při GSC chybí. Han navrhuje po BI resekci resekovat gastroduodenoanastomózu s lymfadenektomií hepatoduodenálního ligamenta, u GSC po BII resekci navrhuje resekci minimálně 10 cm mezenteria jejuna [28]. Kunisaki je radikálnější a upřednostňuje u pokročilého GSC výkon vždy doplnit o splenektomii a paraaortální lymfadenektomii [30]. Vzhledem k tomuto odlišnému přístupu někteří autoři zpochybňují použití 7. vydání TNM klasifikace pro karcinom žaludku u GSC [22,29]. Toto tvrzení je podporováno obtížností dosažení potřebného množství disekovaných lymfatických uzlin (15) ke stanovení kompletního patologického stagingu. Obecně se udává pouze 38% úspěšnost při provedení D2 lymfadenektomie. V naší sestavě jsme však kompletní patologický staging dosáhli vždy u provedené D2 lymfadenektomie, která se nám jevila technicky náročnější. Z těchto důvodů by chirurgická léčba GSC měla být centralizovaná. Počet pacientů s GSC není velký. Operační výkon s anatomickými změnami žaludku a adhezemi se může i zkušenému chirurgovi jevit obtížný. Naše operace byly provedeny vždy otevřeně s laparoskopickým stagingem před provedením laparotomie u poloviny pacientů. Lymfadenektomie zahrnovala vždy i část druhého kompartmentu s podvazem arteria gastrica sinistra. U tohoto typu lymfadektomie jsme však dostatečného počtu uzlin nedosáhli.
ZÁVĚR
Karcinom žaludečního pahýlu patří mezi onemocnění diagnostikovaná v pozdějších stadiích. Pravidelným endoskopickým sledováním však jistě můžeme diagnostikovat větší množství pacientů v časnějších stadiích a tak zlepšit resekabilitu a celkové přežívání. Screeningová endoskopie po parciálních resekcích žaludku pro benignitu by měla být zahájena nejpozději v intervalu 10 let od resekce a dále se řídit dle endoskopických nálezů. Pravidelné provádění endoskopických kontrol pahýlu po resekci pro malignitu k záchytu recidivy by však nemělo být ukončeno po 10 letech a jeho pokračování je nutné k diagnostice GSC. Vzhledem k předešlé chirurgické intervenci a změněné anatomii je lymfatické metastázování GSC odlišné, což musí být bráno na zřetel při operaci.
Vzhledem k počtu pacientů po parciálních resekcích žaludku v minulosti lze počítat s vyšší incidencí tohoto karcinomu zejména ve východní Asii. Přesná data z České republiky nejsou k dispozici. Jak se bude tato incidence nadále vyvíjet, závisí na úspěšnosti léčby karcinomu žaludku a na množství pacientů s časným karcinomem žaludku po STG. Protože v posledních desetiletích byla v naší odborné literatuře tomuto tématu věnována minimální pozornost, považovali jsme za prospěšné shrnout současný pohled na tuto problematiku a uvést vlastní zkušenosti.
Seznam zkratek:
GCS karcinom žaludečního pahýlu
JSSPMG Japonská společnost pro studium
pooperační morbidity po gastrektomii
BI Billrothova resekce žaludku I. typu
BII Billrothova resekce žaludku II. Typu
STG subtotální gastrektomie
TG totální gastrektomie
UICC Union for International Cancer Control
CT výpočetní tomografie
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Tomáš Jínek
Chirurgické oddělení Nemocnice Nový Jičín, a. s.
Purkyňova 2138/16
741 01, Nový Jičín
e-mail: jinek.tomas@gmail.com
Zdroje
1. Sinning C, Schaefer N, Standop J, et al. Gastric stump carcinoma – epidemiology and current concepts in pathogenesis and treatment. Eur J Surg Oncol 2007;33 : 133−9.
2. Lagergren J, Lindam A, Mason RM. Gastric stump cancer after distal gastrectomy for benign gastric ulcer in a population-based study. Int J Cancer 2012;131 : 1048−52.
3. Thorban S, Böttcher K, Etter M, et al. Prognostic factors in gastric stump carcinoma. Ann Surg 2000;231 : 188−94.
4. Viste A, Bjørnestad E, Opheim P, et al. Risk of carcinoma following gastric operations for benign disease. A historical cohort study of 3470 patients. Lancet 1986;2 : 502−5.
5. Balfour DC. Factors influencing the life expectency of patients operated on for gastric ulcer. Ann Surg 1922;76 : 405−8.
6. Ohashi M, Katai H, Fukagawa T, et al. Cancer of the gastric stump following distal gastrectomy for cancer. Br J Surg 2007;94 : 92−5.
7. Nozaki I, Nasu J, Kubo Y, et al. Risk factors for metachronous gastric cancer in the remnant stomach after early cancer surgery. World J Surg 2010;34 : 1548−54.
8. Tanigawa N, Nomura E, Lee SW, et al. Society for the Study of Postoperative Morbidity after Gastrectomy. Current state of gastric stump carcinoma in Japan: based on the results of a nationwide survey. World J Surg 2010;34 : 1540−7.
9. Chen L, Tian H, Chen J, et al. Surgical management of gastric stump cancer: a report of 37 cases. J Zhejiang Univ Sci B 2005;6 : 38−42.
10. Nakayoshi T, Tajiri H, Matsuda K, et al. Magnifying endoscopy combined with narrow band imaging system for early gastric cancer: correlation of vascular pattern with histopathology. Endoscopy 2004;36 : 1080−4.
11. Newman E, Brennan MF, Hochwald SN, et al. Gastric remnant carcinoma: just another proximal gastric cancer or a unique entity? Am J Surg 1997;173 : 292−7.
12. Krýsl I. Karcinom pahýlu žaludku po resekci pro peptický vřed. Rozhl Chir 1976;55 : 396−8.
13. Park JH, Lee JH, Rhee PL, et al. Endoscopic Screening for Remnant Gastric Cancer: Points to be Considered. Gut Liver 2007;1 : 22−6.
14. Komatsu S, Ichikawa D, Okamoto K, et al. Differences of the lymphatic distribution and surgical outcomes between remnant gastric cancers and primary proximal gastric cancers. J Gastrointest Surg 2012;16 : 503−8.
15. Chen CN, Lee WJ, Lee PH, et al. Clinicopathologic characteristics and prognosis of gastric stump cancer. J Clin Gastroenterol 1996;23 : 251−5.
16. Kwon IG, Cho I, Guner A, et al. Minimally invasive surgery for remnant gastric cancer: a comparison with open surgery. Surg Endosc 2014;28 : 2452−8.
17. Takenaka R, Kawahara Y, Okada H, et al. Endoscopic submucosal dissection for cancers of the remnant stomach after distal gastrectomy. Gastrointest Endosc 2008;67 : 359−63.
18. Hirasaki S, Kanzaki H, Matsubara M, et al. Treatment of gastric remnant cancer post distal gastrectomy by endoscopic submucosal dissection using an insulation-tipped diathermic knife. World J Gastroenterol 2008;14 : 2550−5.
19. Lin YS, Chen MJ, Shih SC, et al. Management of helicobacter pylori infection after gastric surgery. World J Gastroenterol 2014;20 : 5274−82.
20. Takeno S, Hashimoto T, Maki K, et al. Gastric cancer arising from the remnant stomach after distal gastrectomy: a review. World J Gastroenterol 2014;20 : 13734−40.
21. Geboes K, Rutgeerts P, Broeckaert L, et al. Histologic appearances of endoscopic gastric mucosal biopsies 10-20 years after partial gastrectomy. Ann Surg 1980;192 : 179−82.
22. Costa-Pinho A, Pinto-de-Sousa J, Barbosa J, etl al. Gastric stump cancer: more than just another proximal gastric cancer and demanding a more suitable TNM staging system. Biomed Res Int 2013; doi: 10.1155/2013/781896.
23. Huang H, Wang W, Chen Z, et al. Prognostic factors and survival in patients with gastric stump cancer. World J Gastroenterol 2015;21 : 1865−71.
24. Tanigawa N, Nomura E, Niki M, et al. Clinical study to identify specific characteristics of cancer newly developed in the remnant stomach. Gastric Cancer 2002;5 : 23−8.
25. Greene FL. Management of gastric remnant carcinoma based on the results of a 15-year endoscopic screening program. Ann Surg 1996;223 : 701−6.
26. Xiong JJ, Altaf K, Javed MA, et al. Roux-en-Y versus Billroth I reconstruction after distal gastrectomy for gastric cancer: a meta-analysis. World J Gastroenterol 2013;19 : 1124−34.
27. Komatsu S, Ichikawa D, Okamoto K, et al. Differences of the lymphatic distribution and surgical outcomes between remnant gastric cancers and primary proximal gastric cancers. J Gastrointest Surg 2012;16 : 503−8.
28. Han SL, Hua YW, Wang CH, et al. Metastatic pattern of lymph node and surgery for gastric stump cancer. J Surg Oncol 2003;82 : 241−6.
29. Li F, Zhang R, Liang H, et al. The pattern of lymph node metastasis and the suitability of 7th UICC N stage in predicting prognosis of remnant gastric cancer. J Cancer Res Clin Oncol 2012;138 : 111−7.
30. Kunisaki C, Shimada H, Nomura M, et al. Lymph node dissection in surgical treatment for remnant stomach cancer. Hepatogastroenterology 2002;49 : 580−4.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek České chirurgické kongresyČlánek Cysta ductus choledochus
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2015 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- České chirurgické kongresy
- Chirurgické možnosti léčby obstipace: stručný přehled
- Karcinom žaludečního pahýlu – unicentrická analýza 7 pacientů
- Cholecystostomie – obsoletní, nebo aktuální řešení?
- Analýza výsledků hybridních revaskularizačních výkonů pro multietážové postižení tepenného systému dolních končetin – výsledky jednoho centra
- Cysta ductus choledochus
- Extraintestinální GIST − kazuistika
- 1st World Conference on Abdominal Hernia Surgery
- Primář Ludvík Winkler slaví šedesátiny
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chirurgické možnosti léčby obstipace: stručný přehled
- Cholecystostomie – obsoletní, nebo aktuální řešení?
- Cysta ductus choledochus
- Extraintestinální GIST − kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



