-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaLéčba akutní pooperační bolesti
Datum publikace: 5. 9. 2019
1 Akutní bolest a její nežádoucí účinky na organismus
Pooperační bolest je jedním z příkladů akutní bolesti (dalšími jsou bolest při porodu, při traumatu, bolest doprovázející akutní onemocnění aj.). Na rozdíl od chronické bolesti, která je samostatným onemocněním a v nové, 11. mezinárodní klasifikaci nemocí má své kódy, je akutní bolest pouhým příznakem. Trvání akutní bolesti je omezeno na dobu, než dojde ke zhojení vyvolávající příčiny, zpravidla by tak mělo nastat do 3 měsíců, jinak lze uvažovat o přechodu do chronicity. Akutní bolest má i svůj ochranný význam, upozorňuje na poškození organismu a vede k obranné reakci či imobilizaci usnadňující hojení. Existuje vzácné genetické onemocnění, které se vyznačuje absencí vnímání bolesti a při kterém jsou její nositelé vystaveni značnému nebezpečí poranění. Na druhou stranu má dlouhodobá akutní bolest celou řadu nežádoucích účinků, pro které je třeba ji léčit. Stimulace sympatiku působí hypertenzi a tachykardii, které vedou ke zvýšeným nárokům na kardiovaskulární systém, ohrožujícím komplikacemi pacienty s preexistujícím onemocněním srdce. Je zhoršená výměna plynů, zejména kyslíku: ve snaze zmenšit bolest po operaci hrudníku či břicha pacienti dýchají menšími dechovými objemy, takže pak mají zhoršené ventilační funkce, hrozí riziko atelektáz, retence sekretů a následných infekcí. K tomu přispívá i reflexní napětí svalů břicha a hrudníku. Další změny jsou uvedeny v tab. 1.
Velkým tématem posledních 20 let je chronická pooperační bolest. Je to situace, kdy po standardní době zhojení operačního traumatu přetrvává bolest související s operací. Výskyt se udává od 8–10 % po operaci tříselné kýly po 50–80 % po amputacích končetin a torakotomiích. Jedním z jasně prokázaných rizikových faktorů pro vznik chronické pooperační bolesti je intenzivní akutní bolest po operaci. Ačkoliv jde možná spíše o varovný příznak než jednoznačnou příčinu, je kvalitní analgezie s využitím všech dostupných metod potenciální prevencí této komplikace. Adekvátní léčba akutní pooperační bolesti nemá tedy jen za cíl zmenšit utrpení pacienta, ale má i dobré medicínské důvody.
Tab. 1 Nežádoucí účinky nedostatečně léčené pooperační bolesti (upraveno podle 1)
Funkční oblast
Reakce na bolest
Příklad klinické manifestace
Oběh
tachykardie
hypertenze
zvýšená spotřeba kyslíku myokardem
hyperkoagulační stav
angina pectoris
infarkt myokardu
hluboká žilní trombóza
Dýchání
pokles ventilace zapříčiněný svalovými spasmy a mělkým dýcháním
atelektázy
pneumonie
Gastrointestinální
zpomalení evakuace žaludku
zpomalení střevní motility
obstipace, nevolnost, zvracení
ileus
Muskuloskeletální
spasmy
poruchy funkce svalů a kloubů
imobilita, sarkopenie
zhoršení rehabilitace
Urogenitální
retence moči
iontová dysbalance
retence tekutin, otoky, hypertenze
uroinfekce
Endokrinní/
metabolická
porucha sekrece mnoha hormonů (ACTH, kortizol, inzulin, katecholaminy)
pokles hmotnosti, sarkopenie
hyperglykemie
horečka
Imunitní
porucha imunitní funkce
infekce
2 Základní mechanismy vzniku a přenosu akutní bolesti
Znalost základních mechanismů přenosu signálu o poškození části těla a jeho dalšího zpracování je důležitá pro výběr terapeutického postupu (viz dále kap. 4 a obr. 4). Transdukce je děj, při kterém vlivem různých faktorů dochází ke stimulaci periferního neuronu. Transmise je přenos nervového impulzu do centrálního nervového systému (CNS), percepce je uvědomění si bolesti a modulace spočívá ve změnách v průběhu přenosu impulzu vedoucích k jeho zeslabení či zesílení. Velmi zjednodušeně lze uvažovat o čtyřech klíčových bodech přenosu, kde lze terapeuticky zasáhnout: periferní nociceptory (nocisenzory), zadní rohy míšní, mozek a sestupné dráhy z mozku do zadních rohů míšních.
Na periferii dochází po poranění k uvolnění řady látek vedoucích k podráždění volných nervových zakončení – nocisenzorů, případně i polymodálních receptorů a mechanoreceptorů a informace je přenášena tenkými nemyelinizovanými vlákny C a tenkými myelinizovanými vlákny Aδ do zadních rohů míšních. Zde dochází ke složité interakci mezi interneurony, kde končí i silnější myelinizovaná vlákna Aβ z periferie, vedoucí dotek, tah a tlak, a také descendentní dráhy z mozku. Impulzy z obou posledně uvedených typů vedou většinou k zeslabení přenosu nociceptivní informace do mozku. Vzestupné dráhy tvoří například tractus spinothalamicus a tractus spinoreticulothalamicus. V thalamu pak dochází k propojení s mnoha dalšími oblastmi mozku (amygdala a hippocampus – paměť, hypothalamus – neurohumorální reakce, kortex – kognice, volní jednání a další).
Descendentní dráhy z mozku do zadních rohů působí většinou inhibičně, mediátory jsou serotonin a noradrenalin a endogenní opioidy (2, 3). Na různých částech dráhy přenášející informace o bolesti jsou spouštěny i reflexy, které vedou k doprovodným reakcím. Segmentální reflexy na úrovni zadních rohů míšních vedou jednak k úhybnému manévru, jednak dlouhodobě ke zvýšenému napětí až spasmům kosterního svalstva s produkcí laktátu, což potencuje bolest. Stimulace sympatických neuronů vede k tachykardii, tachypnoi, retenci moči, hyperglykemii a prodloužení pooperačního ileu. Suprasegmentální reflexy dále zvyšují tonus sympatiku, stimulují osu hypothalamus – hypofýza – nadledviny a vedou ke zvýšení spotřeby kyslíku v organismu a katabolismu. Korové odpovědi jsou komplexní a jsou spojeny se stimulací mnoha dalších systémů (4).
Z mechanismu přenosu a zpracování nociceptivního signálu vyplývá, že nocicepce není totéž co bolest. Nocicepce je proces, jakým se informace o bolesti dostane z místa poranění do mozku, percepce bolesti je to, jak bolest „cítíme/vnímáme“ (obr. 1). Z toho vyplývá, že při stejném typu operace může být spotřeba analgetik mezi různými pacienty odlišná až desetinásobně (5). K tomu přispívá i různá genetická výbava ovlivňující účinek analgetik, zejména opioidů. Kromě tohoto základního mechanismu, kdy mluvíme o bolesti nociceptivní, existuje ještě bolest neuropatická, která vzniká poruchou přenosu signálu při porušení nervu. Často přetrvává jako součást chronické pooperační bolesti, její léčba je obtížná a většinou vyžaduje odeslání pacienta na specializované algeziologické pracoviště.
Obr. 1. Faktory působící na vnímání bolesti (modifikováno dle 6) 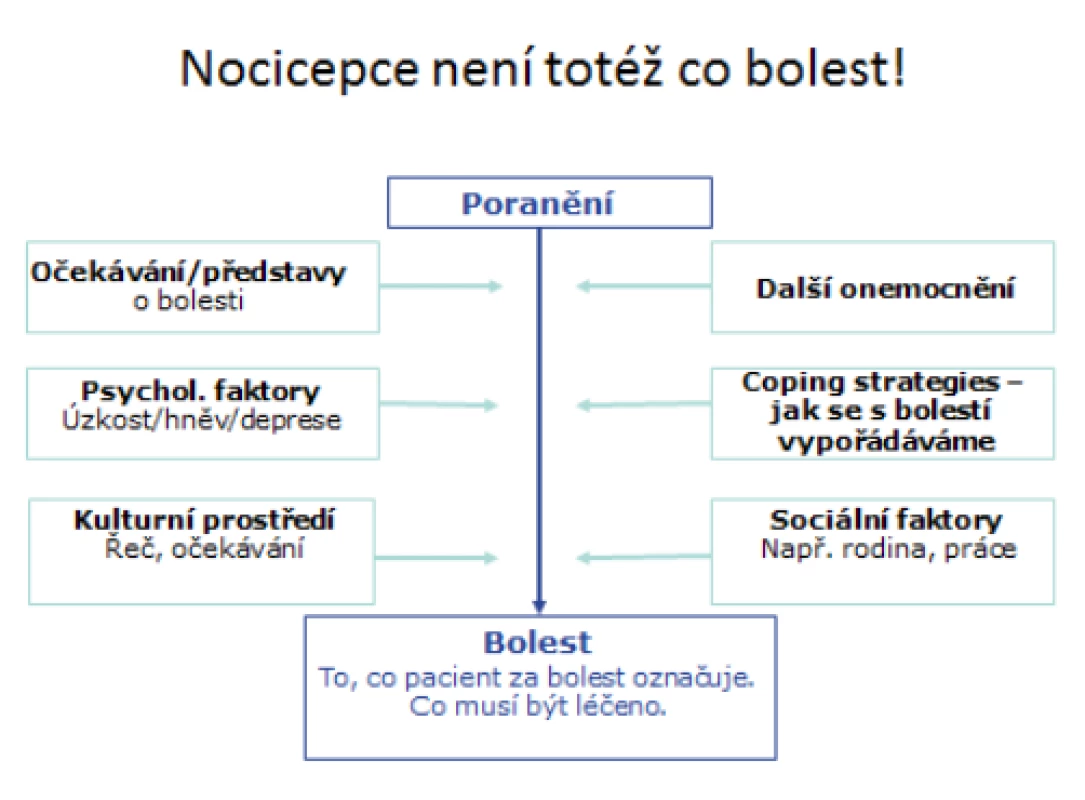
3 Měření intenzity bolesti
Podle definice Mezinárodní společnosti pro studium a léčbu bolesti je bolest definována jako „nepříjemný smyslový a emoční zážitek spojený se skutečným nebo potenciálním poškozením tkáně nebo popisovaný výrazy pro takové poškození“ (7). Z definice vyplývá, že bolest je spojena s negativními emocemi a je subjektivní. Znamená to, že i když je iniciální příčina bolesti u různých osob stejná, například stejný typ operace spojený se stejným chirurgickým traumatem, výsledný prožitek bolesti se mezi nimi může významně lišit.
Obr. 2. Kombinace různých škál pro měření intenzity bolesti: verbální, obličejová, numerická 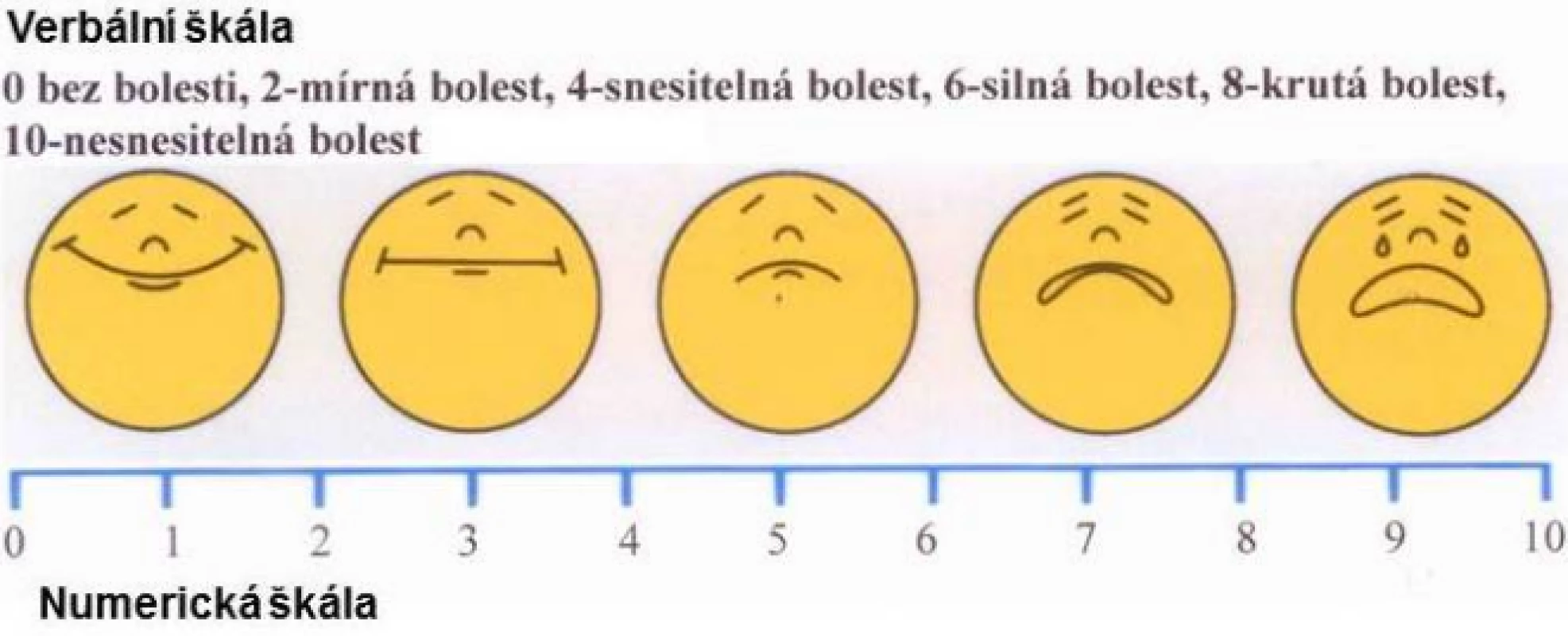
Abychom mohli při rozhovoru s pacientem zhodnotit intenzitu jeho bolesti a rovněž změřit účinek terapie, je nutné subjektivní pocit nějakým způsobem převést na měřitelnou hodnotu. Pro dospělé pacienty po operaci máme několik možností. Všechny vycházejí ze srovnání aktuální bolesti se stavem bez bolesti a s maximálně představitelnou bolestí. Nejjednodušší je jednoduchý slovní popis, dobře pochopitelná je i numerická škála od 0 do 10 nebo od 0 do 100 (obr. 2). Vizuální analogová škála je nejčastěji ve tvaru rozšiřujícího se trojúhelníku s posuvnou ryskou bez čísel, která jsou na straně hodnotitele (obr. 3). U dětí a osob, které nejsou schopny verbálně komunikovat, je situace složitější. Používají se různé skórovací systémy vycházející z hodnot naměřených pozorovatelem – příkladem je skóre CRIES (tab. 2) – nebo obrázky obličejů (obr. 2).
Tab. 2 Skóre CRIES, používané pro hodnocení intenzity bolesti u dětí (modifikováno dle 8)
Crying
vysoký ječivý křik
Requires oxygen potřeba kyslíku pro SpO2 > 95 %
Increased vital signs from baseline zrychlení dýchání a pulzu a zvýšení tlaku nad výchozí hodnoty
Expression
výraz tváře (vraštění obočí, svírání víček, prohloubení nazolabiální rýhy nebo otevření úst)
Sleeplessness spánek během předchozí hodiny
Počet bodů
žádný nebo normální pláč
není třeba
ne
normální
normální spánek
0
pláče, ale dá se
ukonejšit
ano, ale ≤ 30 % v dýchací směsi
ano, ale o ≤ 20 %
grimasování
často se budí
1
pláče a nedá se
ukonejšit
ano, > 30 % v dýchací směsi
ano, o > 20 % v dýchací směsi
kňourání, nářek apod.
trvale vzhůru
2
Pozn.: Při součtu bodů > 4 je nutno podat analgetikum.
Obr. 3. Vizuální analogová škála s ryskou 
4 Faktory ovlivňující intenzitu pooperační bolesti
Mezi neovlivnitelné faktory patří typ operace, komorbidity pacienta, věk a pohlaví. Mezi operace s vysokou pravděpodobností intenzivní bolesti patří například amputace končetin, operace v dutině hrudní a břišní, operace velkých kloubů a operace skolióz. Střední bolest bývá například po operaci kýly, císařském řezu, ORL operacích či mastektomiích. Mírná bolest bývá po endoskopických urologických operacích a malých gynekologických výkonech. Z psychických faktorů je to především způsob zvládání zátěže. Faktor věku nedává jasné výsledky, spíše jde o negativní korelaci mezi věkem a celkovou spotřebou analgetik než o vztah mezi věkem a intenzitou bolesti. Stejně nekonzistentní jsou výsledky týkající se toho, zda ženy vyžadují více analgetik a pociťují větší bolest než muži (9).
Z ovlivnitelných faktorů jde o psychickou přípravu, výběr chirurgického přístupu a typu anestezie, léčbu bolesti po operaci a celkovou kvalitu pooperační péče.
5 Možnosti terapie pooperační bolesti
Znalost mechanismů přenosu i potlačení nociceptivní informace jsou výhodné pro výběr a kombinaci různých postupů. Na různých místech můžeme zasahovat odlišnými postupy, které nám umožní jednak přizpůsobit léčbu typu operace a předpokládané intenzitě bolesti (analgezie individualizovaná podle typu operace, PSA – procedure specific analgesia), jednak oproti použití jedno typu analgetika využít látek z různých skupin působících různým mechanismem, což umožní snížit jednotlivé dávky i nežádoucí účinky s vysokými dávkami spojené a současně zajistit kvalitní analgezii (multimodální analgezie) – viz dále a obr. 4. Podle použité metody lze léčbu pooperační bolesti rozdělit na následující skupiny (10):
-
psychologické metody,
-
fyzikální postupy,
-
farmakoterapie
-
systémová,
-
lokoregionální,
-
-
kombinované postupy.
Obr. 4. Analgetické postupy podle místa působení 
Pozn.: TENS – transkutánní nervová stimulace 5.1 Psychologické metody
Společným jmenovatelem těchto metod je to, že prakticky nemají kontraindikace, a dále to, že jsou většinou pouze metodami podpůrnými. Z faktorů, které by mohly ovlivnit intenzitu pooperační bolesti, byly studovány převážně tři: úzkost, další psychické faktory (hostilita, neurotismus) a způsob zvládání zátěže (coping strategy). Z nich se jako nejúčinnější jeví odstranění úzkosti, k dalším možnostem patří emoční podpora a postupy odvozené od víry pacientů. Účinek hypnózy nebyl potvrzen (11).
5.2 Fyzikální a nefarmakologické prostředky
K tradičním fyzikálním postupům léčby akutní bolesti, zejména u traumat, patří elevace, chlazení či teplo mírnící spasmy a imobilizace. V pooperačním období mají tyto metody, možná s výjimkou povrchních výkonů, svoje omezení. Elevace operované části je většinou nemožná, chlazení je dlouhodobě nepříjemné, teplo zvyšuje riziko infekce a krvácení a namísto imobilizace je třeba co nejrychlejší mobilizace a rehabilitace pacientů. Kontroverzní výsledky se týkají rovněž využití akupunktury v léčbě pooperační bolesti a použití transkutánní nervové stimulace (TENS). Obě metody patří mezi stimulační postupy ovlivňující přenos nociceptivního signálu v oblasti zadních rohů míšních. Ani jedna z uvedených metod se v pooperační analgezii nepoužívá rutinně (10).
Placebo efekt je dobře prokázaný. Jeho účinek je podle použitého postupu různě velký, ale vždy pozitivní. Placebo ovlivňuje mnoha různými mechanismy nejen psychickou, ale i fyziologickou odpověď na bolest (12). Znamená to, že analgetický účinek placeba je měřitelný, a není to v žádném případě důkaz toho, že pacient si svoji bolest jen vymýšlel. Je třeba počítat i s tím, že existuje opačný účinek – nocebo, jehož vliv je vždy negativní.
5.3 Farmakoterapie
Při výběru analgetika a způsobu jeho aplikace je nutné uvážit základní faktory: vhodnost pro konkrétního pacienta a konkrétní typ operace, bezpečnost, dostupnost metody v daném zařízení a s daným personálem a konečně i ekonomickou stránku léčby (13).
Nejjednodušší a nejlevnější je perorální (p. o.) podání. Hlavním předpokladem tohoto způsobu podání je to, že pacient musí mít funkční gastrointestinální trakt (GIT), což u některých typů operací nelze v bezprostředním pooperačním období zaručit. Navíc je rychlost vstřebávání ovlivněna mnoha skutečnostmi (náplň žaludku, motilita tenkého střeva, průtok krve játry), takže je relativně velká interindividuální variabilita nástupu účinku, zhruba mezi 20 a 60 minutami.
Intramuskulární (i. m.) podání nemá nevýhodu závislosti nástupu účinku na funkci GIT, látka se dostává do oběhu prostou difuzí, látky s velkou molekulou lymfatickým oběhem. Rychlost vstřebávání závisí především na prokrvení místa podání, což lze podpořit zahřátím či masírováním příslušného místa. Účinek nástupu je rychlejší po podání do deltového, event. stehenního svalu než do svalu hýžďového. Nástup účinku je pomalejší než po intravenózním podání, maximální dosažená koncentrace bývá nižší a trvání účinku delší. Výhodou je jednoduchá aplikace, nástup účinku je mezi 20 a 30 minutami, nevýhodou je opakovaná bolestivá aplikace.
Subkutánní (s. c.) způsob podání se preferuje zejména při podávání opioidů. V některých případech lze zavést tenkou jehlu či kanylu do podkoží a podávat touto cestou opioidy kontinuálně.
Při intravenózním (i. v.) podání se látka dostává přímo do centrálního kompartmentu, nástup účinku bývá promptní (desítky sekund až minuty) a účinek je relativně dobře předvídatelný a pozorovatelný, což může pomoci při volbě dávky. Hlavní nevýhodou jsou problémy se zajištěním a udržením žilního vstupu.
Rektální (p. r.) podání není u pacientů příliš oblíbené, nástup účinku je pomalý a rozdíly v účinnosti velké.
Netradiční způsoby podání (bukální, sublingvální, nazální, iontoforetické) se týkají téměř výlučně opioidů. K léčbě pooperační bolesti nejsou tyto způsoby v ČR registrované.
Lokoregionální metody analgezie spočívají v podávání místních anestetik, někdy i s opioidy a adjuvantními látkami (klonidin), jednorázově či kontinuálně. Metody aplikace sahají od těch nejjednodušších, jako je infiltrace operační rány, přes zavedení katétrů pro kontinuální podávání do různých anatomických vrstev operační rány, aplikaci k jednotlivým nervům a plexům až po metody neuroaxiální (epidurální, subarachnoidální). Společnou vlastností lokoregionálních metod analgezie je dobrá účinnost, pokud jsou správně vybrány a provedeny, a s výjimkou neuroaxiálních metod i málo kontraindikací a vedlejších účinků. S výjimkou infiltrace rány a zavádění katétrů do rány spadají do anesteziologické péče, a proto nebudou dále rozebírány. Specifickou oblast představuje péče o pacienty s neuroaxiálními metodami analgezie, která bude zmíněna dále.
Pacientem kontrolovaná analgezie je metoda, při níž si pacient sám stisknutím vypínače aplikuje dávku analgetika (opioidu) do žíly, méně často epidurálně. Základními parametry, které pacient nemá možnost ovlivnit, jsou bolusová dávka aplikovaná na jedno spuštění přístroje, bezpečnostní interval (lock-out interval) – doba, po kterou přístroj nedávkuje, ani když ho pacient spouští, a zpravidla i maximální celková dávka analgetika za 4 nebo 6 hodin. Základem úspěchu je před zahájením PCA podat nasycovací dávku analgetika tak, aby byla bolest účinně potlačena ještě před nasazením přístroje. Použití vyžaduje spolupráci pacienta (lze očekávat již od 6 let věku) a jeho fyzickou schopnost obsluhovat ovládání přístroje. Hlavními výhodami jsou oproti jinému systémovému způsobu podávání opioidů větší spokojenost pacienta a kvalitnější analgezie. Nežádoucí účinky zůstávají stejné jako při jiných způsobech podání. Přístroje umožňují kromě bolusového podání většinou i základní infuzi analgetika, která ale podle některých studií zvyšuje riziko předávkování a nemá vliv na kvalitu analgezie.
Látky používané k systémové analgezii spadají do třech základních skupin: neopioidní analgetika (analgetika-antipyretika), nesteroidní analgetika a opioidy. K lokoregionální analgezii se používají místní anestetika, při neuroaxiálním podání často s přídavkem opioidu. Jednotlivá farmaka jsou uvedena dále (10, 13, 14).
5.3.1 Systémově podávaná neopioidní analgetika (analgetika-antipyretika)
Do této skupiny spadají pouze dvě látky: paracetamol a metamizol. Mají stropní efekt – zvyšování dávky nad doporučenou nevede k zesílení analgetického účinku, pouze účinků nežádoucích. Jsou určeny pro tlumení mírné až středně silné bolesti a v kombinaci s dalšími látkami, zejména s opioidy, i k tlumení silné bolesti.
Paracetamol
Paracetamol je asi nejužívanější lék této skupiny. Analgezii vyvolává dosud ne zcela známým mechanismem. Lze ho podat mnoha způsoby: p. o., p. r. i i. v. Po perorálním podání je nástup účinku 15–20 minut, při rektálním podání je vstřebávání nejisté, první dávka nemusí dosáhnout účinné koncentrace ani při 40 mg/kg. Výhodou i. v. podání je především rychlý nástup účinku, 3–10 minut. Paracetamol je metabolizován především v játrech, trvání účinku je asi 3–6 hodin (antipyretický účinek 3–4 hodiny). Rizikem je jeho hepatotoxicita při překročení dávky asi 150 mg/kg. Současné podání paracetamolu a blokátorů 5-hydroxytryptaminového receptoru typu 3 (5HT3) s výjimkou ondansteronu vede k vzájemné eliminaci účinnosti.
Při perorálním podání se dospělým a mladistvým dává 0,5 až 1 g paracetamolu podle potřeby v časovém odstupu nejméně 4 hodin do maximální denní dávky 4 g, nejvyšší jednotlivá dávka je 1 g. Při dlouhodobé terapii (nad 10 dnů) nemá denní dávka překročit 2,5 g. Paracetamol lze podávat i během těhotenství a kojení. U dětí nemá celková denní dávka za 24 hodin překročit 50 mg/kg tělesné hmotnosti dítěte; dělí se na 3–4 dílčí dávky. Při jednorázovém podání je dávka 10–15 mg/kg tělesné hmotnosti.
Při intravenózním podání se paracetamol podává v infuzi trvající 15 minut s minimálním 4hodinovým intervalem mezi jednotlivými dávkami. U dospělých a mladistvých s hmotností nad 50 kg se podává 1 g až 4× denně, maximálně 4 g za den, u dětí o hmotnosti nad 33 kg (přibližně od 11 let) nebo u dospělých a mladistvých s hmotností do 50 kg je jednotlivá dávka 15 mg/kg, maximálně 60 mg/kg za den (přitom nepřekročit 3 g), u dětí o hmotnosti nad 10 kg (přibližně od 1 roku) a méně než 33 kg je jednotlivá dávka 15 mg/kg, maximální denní dávka nesmí překročit 60 mg/kg (přitom nepřekročit 2 g), u novorozenců narozených v termínu, kojenců, batolat a dětí o hmotnosti do 10 kg (přibližně do 1 roku) je jednotlivá dávka 7,5 mg/kg hmotnosti, maximální denní dávka nesmí překročit 30 mg/kg hmotnosti.
Metamizol
Metamizol je již dlouho používaným neopioidním analgetikem. Přestože je dostupný i v perorální formě, v pooperační analgezii se používá především v injekční formě v infuzi, u dětí ve věku mezi 3 a 11 měsíci smí být injekce podána výhradně intramuskulárně. Kontraindikací je kromě alergie i porucha krvetvorby, alergické astma vyvolané nesteroidními protizánětlivými léky, jaterní porfyrie, 3. trimestr těhotenství a kojení (znovu začít kojit lze po 48 hod. od podání metamizolu). Opatrnosti je třeba u pacientů s dalšími formami astmatu, chronickou urtikarií, přecitlivělostí na alkohol, osob starých a při hypotenzi a hypovolemii. Nejobávanější, byť vzácný nežádoucí účinek je těžká, život ohrožující anafylakticko-anafylaktoidní reakce, častěji může být ve formě kožní reakce. Alergická reakce se může rozvinout i za několik hodin po podání. Dále se může vyskytnout izolovaná hypotenze. Vzácně se může rozvinout leukopenie a velmi vzácně agranulocytóza nebo trombocytopenie a selhání funkce ledvin.
Jednotlivá dávka u dospělých je 8–16 mg/kg pro perorální podání a 6–16 mg/kg pro parenterální podání, maximálně 5 g denně, u dětí většinou 10–15 mg/kg maximálně 4× denně, u dětí ve věku 3–11 měsíců smí být parenterálně aplikován pouze intramuskulárně. Rychlé infuzní podání působí hypotenzi, která je znatelnější při existující hypovolemii. Dávka 2,5 g se doporučuje podávat v 500ml infuzi, ale podání ve formě infuze je vhodné i pro nižší dávky. Podle velikosti maximální denní dávky lze jednotlivou dávku podat až 4× denně v intervalech 6–8 hodin. U dospělých s vyšší hmotností lze jednotlivou dávku zvýšit až na 2,5 g a maximální denní dávka je 5 g.
Při kolikovitých bolestech hladkého svalstva, například po instrumentálním vyšetření v urologii nebo endoskopii trávicího systému, je výhodná kombinace metamizolu se spasmolytikem pitofenonem a fenpiverinem (v injekční formě Analgin, p. o. Algifen). U Analginu obsahuje jedna 5ml ampule 2 500 mg metamizolu. Injekce se podává pomalu i. v. (1 až 1,5 ml za minutu, nástup účinku 2–20 minut) nebo i. m. (nástup účinku 20–30 minut). Jednotlivé dávky se mohou opakovat po 6 až 8 hodinách. Jednotlivá dávka pro dospělého je do 5 ml přípravku, u dětí ve věku 7–12 let 0,6–1 ml, u dětí ve věku 1–6 let 0,3–0,5 ml a u kojenců starších 4 měsíců 0,2–0,3 ml.
5.3.2 Nesteroidní antiflogistika (NSA)
NSA tvoří rozsáhlou skupinu, která se tradičně dělí podle toho, jak inhibuje enzym cyklooxygenázu (COX), na inhibitory COX neselektivní a na selektivní inhibitory COX-2 – koxiby. Podobně jako předchozí skupina mají při analgezii stropní účinek a jsou určeny pro tlumení mírné až středně silné bolesti a v kombinaci s dalšími látkami, zejména s opioidy, i k tlumení silné bolesti. Oproti předchozí skupině jsou účinnější u bolesti se zánětlivou složkou. Jejich použití v pooperační analgezii je kontroverzní: na jednu stranu snižují spotřebu a tím i sekundárně nežádoucí účinky opioidů, na druhé straně byly publikovány obavy z jejich nežádoucího efektu na hojení kostí a střevních anastomóz.
Pokud se používají k léčbě pooperační bolesti, mělo by být jejich užití co nejkratší a měly by být respektovány kontraindikace: riziko krvácení, anamnéza alergie, těžké hypertenze, onemocnění srdce nebo jaterní a renální insuficience. Další kontraindikací je třetí trimestr těhotenství (mohou vést k předčasnému uzávěru Botallovy dučeje), přičemž se podávání nedoporučuje ani v prvním a druhém trimestru. Mohou se použít během laktace, pokud se nepodávají vysoké dávky a léčba je krátkodobá. Z mnoha dostupných preparátů budou uvedeny jen ty, které mají kromě perorální též parenterální možnost podání.
Ibuprofen
Ibuprofen patří mezi neselektivní blokátory COX. Je dostupný pro podání p. o., p. r. i i. v. Denní dávka u dospělých by neměla překročit 400 mg, rozděleně na 3–6 dávek, u dětí do 12 let věku 20–35 mg/kg ve 3–4 dílčích dávkách. Nástup účinku je asi 30 minut po p. o. a p. r. podání, trvání analgetického účinku závisí na rozdělení denní dávky, například pokud se 2400 mg rozdělí do 6, 4 či 3 dávek, je trvání účinku 4, 6, resp. 8 hodin.
Intravenózní podání je ve formě infuze, která by měla trvat 30 minut, a je určeno jen pro dospělé. Maximální koncentrace je při této rychlosti infuze dosaženo za 40 minut. Jednotlivá dávka je 600 mg, další lze podat po 6 až 8 hodinách do maximální denní dávky 1200 mg. Trvání i. v. léčby by nemělo přesáhnout 3 dny.
Diklofenak
Diklofenak je typický zástupce neselektivních inhibitorů COX. Má velmi dobré analgetické účinky na bolest se zánětlivou složkou a bolest po extrakci zubů. Je k dispozici pro podání p. o., v injekční formě pro i. m. podání nebo do infuze. V infuzní formě existuje registrovaná fixní kombinace diklofenaku s centrálním svalovým relaxanciem orfenadrinem (Neodolpasse) se spasmolytickým účinkem na kosterní svalstvo a mírným vlastním analgetickým účinkem (Vymazal; viz dále adjuvantní látky).
Perorální podání: počáteční dávka u dospělých je 100–150 mg denně, u méně závažných stavů a dětí nad 12 let obvykle postačuje 75–100 mg denně rozdělených do 2–3 dílčích dávek. Denní dávka u dospělých by neměla překročit 150 mg.
Parenterálně jen u dospělých: injekce 75 mg diklofenaku hluboko intramuskulárně do horního zevního kvadrantu gluteálního svalu, při silné bolesti odděleně 150 mg. Při i. v. lze podat 75 mg diklofenaku pouze v infuzi, která musí trvat 0,5–2 hodiny a musí být připravena bezprostředně před aplikací. V léčbě pooperační bolesti se ihned po výkonu podává 25–50 mg diklofenaku v infuzi trvající 15 minut až 1 hodinu, dále se pokračuje kontinuální infuzí 5 mg/hod. až do maximální denní dávky, která by neměla překročit 150 mg. Infuze by se neměly podávat déle než 2 dny. Infuze Neodolpasse by měla trvat 1,5–2 hodiny, při nedostatečném účinku může být podána ve stejný den ještě jedna infuze, nejdříve však po 8 hodinách.
Ketoprofen
Zdá se, že ketoprofen přináší oproti ostatním látkám z této skupiny vyšší rizika (nežádoucí účinky na gastrointestinální trakt a vyšší riziko kožních reakcí, včetně život ohrožujících bulózních reakcí). Přípravek je určen pouze pro pacienty starší 15 let. Obvykle se podává 100 mg až 200 mg ketoprofenu denně v závislosti na charakteru onemocnění a celkovém zdravotním stavu pacienta.
Maximální denní dávka ketoprofenu podávaného p. o. i parenterálně je 200 mg. Injekce je možné aplikovat hluboko intramuskulárně (100 mg 1–2× denně) nebo v infuzi. Infuzní lahev s ketoprofenem by měla být obalena a chráněna před světlem, které ho rozkládá. Infuze se 100 mg či 200 mg ketoprofenu by měla trvat alespoň 30–60 minut a je možnost i kontinuální aplikace v infuzi trvající 8 hodin. Minimální interval mezi infuzemi je 8 hodin. Parenterálně se doporučuje podávat ketoprofen maximálně 2 dny. Ketoprofen v infuzi lze kombinovat s morfinem, nelze kombinovat s tramadolem – dochází k precipitaci.
Piroxikam
Podobně jako ketoprofen má vyšší riziko závažných reakcí. Je dostupný v injekční (pouze i. m.) i perorální formě. Lze ho použít na léčbu akutní pooperační bolesti u pacientů starších 14 let, použití v těhotenství a při kojení je kontraindikováno. Při silných bolestech se podává 1× denně 40 mg piroxikamu, při mírných bolestech 1× denně 20 mg. Trvání léčby musí být stanoveno individuálně, obvykle se doporučují 1–2 dny.
Parekoxib
Parekoxib je jediná látka ze skupiny koxibů, která je určena přímo pro krátkodobou pooperační analgezii u osob starších 18 let. Nežádoucí účinky a kontraindikace viz obecná charakteristika NSA. Parekoxib je kontraindikován k léčbě bolesti po koronárním by-passu, v posledním trimestru těhotenství a během kojení. Další omezení jsou podobná jako u jiných NSAID. Vzhledem k tomu, že je dostupný v injekční formě, je jeho použití v perioperačním období velmi výhodné, a to i tam, kde jsou obavy ze zhoršené funkce destiček (centrální míšní blokády, ORL výkony, endoskopické urologické výkony). Podává se i. v. i i. m. v dávce 40 mg, maximální denní dávka je 80 mg.
5.3.3 Opioidy
Opioidy působí na opioidních receptorech, které se vyskytují v CNS i mimo něj. V léčbě pooperační bolesti se používají především látky vážící se na mí-opioidní receptory. Prototypem této skupiny je morfin. Podle aktivity se morfiniformní opioidy dělí na slabé (mají stropní účinek, další zvyšování dávky nezlepší analgezii) a silné, které stropní účinek nemají, ale maximální dávka je limitována vedlejšími účinky, především obávaným útlumem dechu. Typické je na prvním místě zpomalení dechové frekvence, známkou předávkování je frekvence pod 10 dechů za minutu. U lehčího předávkování může pacient dechovou frekvenci na výzvu zvýšit, ale pokud dojde i k útlumu vědomí, je nutno zahájit umělou plicní ventilaci, případně podat antidotum.
Pro tyto případy je třeba mít k dispozici specifické antidotum opioidů – naloxon. Dávka naloxonu je 0,2–0,4 mg i. v. a je třeba počítat s tím, že možná bude muset být opakována zhruba po 45–60 minutách. U pacientů dlouhodobě užívajících opioidy hrozí kromě zrušení analgezie i vyvolání abstinenčního syndromu: neklid, úzkost, třes, průjem, pocení, slzení, zvýšená sekrece z nosu, tachykardie a hypertenze.
Mezi další nežádoucí účinky opioidů patří nevolnost a zvracení, zpomalení motility střev a vyprazdňování žaludku, retence moči, sedace, vzácně euforie nebo dysforie či halucinace. Vzhledem k psychickým účinkům existuje možnost jejich zneužití a při podávání silných opioidů je třeba respektovat zákon o návykových látkách. Méně známým nežádoucím účinkem je svalová rigidita a svědění kůže, zejména při jejich neuroaxiální aplikaci. Opioidy mohou působit pokles tlaku a bradykardii, takže může dojít k ortostatickému kolapsu.
Mezi kontraindikace opioidů patří alergie, nitrolební hypertenze, kraniocerebrální poranění bez umělé plicní ventilace, terapie inhibitory monoaminooxidázy a porfyrie. Opioidy používané krátkodobě v běžných dávkách k pooperační analgezii lze používat během těhotenství i kojení. Opatrnosti je však třeba při podání bezprostředně před porodem, protože přecházejí přes placentární bariéru a hrozí útlum dechu novorozence. Při použití v pediatrii je obecně nutný zvýšený dohled, zejména kontrola dýchání po operaci. Citlivější na podávání opioidů jsou rovněž starší nemocní. Postup u pacientů chronicky užívajících opioidy je uveden v kap. 9.
Potenciálně nebezpečná je kombinace opioidů s benzodiazepiny. Benzodiazepiny nemají analgetický účinek, a navíc významně potencují sedaci a zvyšují riziko dechové deprese. Pokud jsou podávány během operace pro svůj amnestický účinek nebo v rámci pooperační péče k terapii úzkosti, pacient musí být pečlivě monitorován (15).
Tramadol
Tramadol je nejpoužívanější zástupce slabých opioidů. Další z nich (kodein a dihydrokodein) se v léčbě pooperační bolesti v ČR prakticky nevyužívají. Tramadol je prodrug, v játrech musí být metabolizován na analgeticky účinný O-demethyltramadol. Je dostupný v mnoha lékových formách pro parenterální, perorální i rektální podání. Samotný je účinný jen při mírné bolesti, ale v kombinaci s NSA nebo neopioidními analgetiky je výsledná kombinace analgeticky mnohem účinnější.
Častým vedlejším účinkem je nevolnost, zvracení a závratě. Tramadol může zesílit působení selektivních inhibitorů zpětného vychytávání serotoninu – SSRI (hrozí i život ohrožující serotoninový syndrom), tricyklických antidepresiv, antipsychotik a jiných léků, které snižují práh vzniku záchvatů, a může vyvolat křeče. Neměl by být podáván s inhibitory monoaminooxidázy. Při současném podání blokátorů 5-hydroxytryptaminového receptoru typu 3 (například ondansteronu) dochází ke snížení účinku tramadolu.
U dětí starších 1 roku se podává 1–2 mg/kg po 4–6 hodinách, u mladistvých a dospělých by neměla být překročena denní dávka 400 mg. Při nedostatečném účinku nemá vzhledem ke stropnímu efektu smysl zvyšovat dávku a je třeba přejít na silný opioid. Doplňovat nedostatečnou analgezii po silném opioidu tramadolem je kontraproduktivní.
Morfin
Morfin je prototypem celé skupiny silných opioidů. Poskytuje potentní analgetický účinek, který se stupňuje se stoupající dávkou, a ačkoliv nepotlačí bolest zcela, výhodou jsou jeho centrální účinky, (euforie nebo mírná sedace), které zvyšují toleranci bolesti. Další výhodou jsou nízká cena, předvídatelný účinek, malý vliv na parenchymové orgány a žádný vliv na hemokoagulaci a možnost použití i u dětí.
Může být podán mnoha způsoby: i. m., s. c., i. v., jinak i p. o., p. r., epidurálně, intratekálně. P. o. dávky u dospělých jsou iniciálně 10–30 mg; i. v., i. m., s. c. 0,1 mg/kg (při intravenózním podání vždy frakcionovaně). Prvý nástup účinku lze po i. v. podání pozorovat do 5 minut, ale maximální účinek je až po 15 minutách, po i. m. a s. c. podání je nástup účinku do 30–40 minut. Účinek trvá 4 hodiny.
Morfin se v játrech metabolizuje na farmakologicky účinný metabolit morfin-6-glukuronid, který se vylučuje primárně močí. Při závažném onemocnění ledvin hrozí riziko kumulace. Pokud je při terapii morfinem a spontánní ventilaci podáván kyslík, může vzniknout závažná dechová deprese s život ohrožující hyperkapnií, i když pulzní oxymetr ukazuje normální hodnoty. K dispozici jsou již kapnometry, které měří vydechovaný CO2 nazální sondou a na tuto komplikaci upozorní.
Pethidin
Pethidin patří mezi silné opioidy, ale má některé unikátní vlastnosti, které připomínají slabé lokální anestetikum. Kromě toho pethidin potlačuje třes jako reakci na chlad. Oproti jiným opioidním analgetikům je jeho účinek významně slabší (10× slabší než u morfinu, 1000× slabší než u fentanylu a 10 000× slabší než u sufentanilu). Dávky jsou 0,25–0,5 mg/kg, podávané velmi pomalu či frakcionovaně i. v., případně 1–1,5 mg/kg i. m. či s. c. Nástup účinku je po i. v. podání do 2–5 minut, po i. m. a s. c. podání do 15–20 minut. Poločas je 3,6 hodiny, ale nástup i trvání účinku se u téže osoby liší po intramuskulárním či subkutánním podání až 2× a mezi různými osobami až 5×.
Pethidin se navíc v játrech metabolizuje na farmakologicky účinný metabolit norpethidin, který se může při delším podávání a především při závažném onemocnění ledvin kumulovat a kromě analgezie vyvolávat i podráždění, myoklonus a křeče. V současnosti se považuje za obsoletní lék a kromě léčby pooperačního třesu se jeho podávání nedoporučuje.
Piritramid
Účinky je podobný morfinu, ale s delším účinkem (asi 6 hodin), eliminace není závislá na renálních funkcích. Při aplikaci i. m. nebo s. c. je jednotlivá dávka 15–30 mg u dospělých a 0,05–0,2 mg/kg tělesné hmotnosti u dětí. K intravenóznímu podání (pouze při požadavku zvláště rychlého nástupu účinku) je doporučena dávka u dospělých 7,5–22,5 mg za dodržení podmínky pomalé aplikace (10 mg za minutu). Jednotlivá dávka pro děti činí 0,05 až 0,1 mg/kg tělesné hmotnosti. V případě poklesu účinku může být intramuskulární, subkutánní nebo intravenózní aplikace opakována zpravidla každých 6–8 hodin. Dávkování by mělo být sníženo u starších pacientů, u pacientů s poruchou jaterních funkcí nebo u pacientů v celkově špatném fyzickém stavu.
Fentanyl a sufentanil
Jde o krátce působící opioidy, které se využívají především v léčbě bolesti u pacientů na monitorovaném lůžku na jednotkách intenzivní péče. Dávkují se přísně individuálně titračním způsobem, nástup účinku je okolo 2 min. Pokud se podávají kontinuální infuzí, poskytují sice kvalitnější analgezii, ale s větším rizikem předávkování. Z obou přípravků se méně kumuluje sufentanil.
5.3.4 Adjuvantní látky
Z uvedeného přehledu je pro léčbu akutní pooperační bolesti schválena pouze fixní kombinace diklofenaku s orfenadrinem a pro analgosedaci při akutní bolesti ketamin. Mimo schválenou indikaci se k systémové léčbě pooperační bolesti zkoušely s větším či menším úspěchem látky původně určené pro jiné použití. Nejvíce studované byly lidokain, ketamin a gabapentinoidy – gabapentin a pregabalin.
Lidokain
Systémové podávání lokálního anestetika lidokainu je mimo schválenou indikaci používáno k léčbě pacientů po výkonech pro kolorektální karcinomy. Kromě snížení spotřeby ostatních anestetik zkracuje pooperační ileus a pobyt na jednotkách intenzivní péče. Iniciální dávkování je 1,5–1,0 mg/kg v krátkodobé infuzi ještě před začátkem operace a pokračuje se formou kontinuální infuze zhruba 0,02 mg/kg/min. po dobu 24 hodin.
Ketamin
Ketamin je unikátní látka, která v závislosti na dávce vyvolá celkovou anestezii, specifickou analgezii nebo pouze potencuje účinek opioidů a snižuje riziko vzniku tolerance na jejich analgetické účinky. V této indikaci je rovněž mimo schválenou indikaci, doporučené dávky by neměly být vyšší než 0,35 mg/kg jako i. v. bolus, resp. kontinuálně do 1 mg/kg/hod., ačkoliv běžně stačí dávky 1–2 mg/kg/24 hod. Kontraindikací je závažné kardiovaskulární onemocnění, těhotenství, psychózy a zvýšený nitrolební a nitrooční tlak.
Gabapentinoidy
Přes intenzivní výzkum není tato skupina v současnosti jako adjuvans k léčbě pooperační bolesti doporučována, protože nežádoucí účinky, zejména sedace, převyšují výhody z mírného snížení spotřeby opioidů a jejich vedlejších účinků.
Orfenadrin
Orfenadrin je látka vykazující až 24 hodin trvající myorelaxační a vlastní analgetický efekt (16). V ČR je registrován ve fixní kombinaci obsahující ve 250 ml infuzního roztoku 75 mg diklofenaku a 30 mg orfenadrinu pro pacienty starší 18 let. Infuze by měla trvat 1,5–2 hod., podává se jednou, maximálně 2× denně s odstupem minimálně 8 hodin. V SPC je jako indikace u pooperační bolesti uvedena akutní bolest po některých neurochirurgických operacích, v praxi lze očekávat přítomnost spasmu kosterního svalstva a související bolesti u pacientů s rozsáhlejšími výkony na páteři a hrudním koši, po některých ortopedických operacích, ale někdy i v důsledku vynucené polohy nebo fixace pacienta během operace (Vymazal). Účinek se s diklofenakem vzájemně potencuje, nežádoucí účinky se v kombinaci s diklofenakem nezvyšují.
6 Lokoregionální metody analgezie
Jde o velice rychle se rozvíjející metody pooperační analgezie. Výhodou je s výjimkou neuroaxiálních blokád minimum vedlejších účinků a dobrá analgetická účinnost. Kombinují se roztoky místních anestetik a opioidy, aplikace je buď jednorázová, nebo kontinuální. Při neuroaxiálním podání opioidů je třeba, aby byl pacient umístěn na monitorovaném lůžku. Provádění jednotlivých nervových blokád je doménou anesteziologů a mimo rozsah tohoto článku, pro praxi na pooperačních odděleních je důležité rozpoznat komplikace, především toxickou reakci na místní anestetika a hematom v páteřním kanále.
6.1 Toxicita místních anestetik
Toxická reakce vznikne, pokud se velké množství místního anestetika vstřebá do oběhu a začne vyvolávat systémové účinky. Nejprve se většinou objeví příznaky neurologické, při vyšší koncentraci v plazmě i příznaky oběhové. Varovnými známkami toxicity jsou kovová chuť v ústech, tupý pocit na jazyku, ospalost, závrať, znění v uších, nystagmus, poruchy vidění, smazaná řeč, svalový třes, kolapsový stav a arytmie.
Při progredující intoxikaci pokračují neurologické příznaky postupně jako trnutí jazyka, logorea, brnění prstů, závratě, poruchy zraku a sluchu, třes svalů až posléze bezvědomí, křeče a zástava dýchání. Terapie neurologických příznaků spočívá v ukončení aplikace, zajištění přístupu do žíly, pokud ho pacient ještě nemá, podání kyslíku a diazepamu po 2,5 mg i. v. a zahájení umělé plicní ventilace.
Kardiotoxicita se někdy projeví na začátku tachykardií a hypertenzí při stimulaci CNS, pokračuje pokles srdečního výdeje, hypotenze, periferní vazodilatace, bradykardie nebo arytmie až konečně může dojít k srdeční zástavě. Je třeba pacienta uložit do horizontální polohy, zajistit přístup do žíly, infuzní terapii, podat kyslík, vazopresory (efedrin, noradrenalin, adrenalin) a v případě srdeční zástavy provádět dlouhodobou kardiopulmonální resuscitaci. Lékem volby je podání 20% roztoku tukové emulze (např. Intralipidu). Pro úvodní i. v. bolusovou dávku 20% lipidové emulze se doporučuje 1,5 ml/kg (asi 100 ml), pak se pokračuje v infuzi rychlostí 0,25 ml/kg/min. (tj. asi 18 ml/min.) až do dosažení hemodynamické stability a dále po dobu ještě 10 minut. Nedojde-li ke stabilizaci krevního oběhu, lze úvodní dávku 1–2× opakovat a rychlost infuze zvýšit na 0,5 ml/kg/min. Maximální dávka v průběhu 30 minut je přibližně 10 ml/kg (17).
Hematom v páteřním kanálu
Nejčastější příčinou je subarachnoidální či epidurální punkce u pacientů s iatrogenní poruchou koagulace krve. Asi třetina hematomů vzniká nikoliv při punkci či zavádění epidurálních katétrů, ale při jejich vytažení. Nejčastěji jsou v perioperačním období používány nízkomolekulární hepariny. Poslední profylaktickou dávku lze podat minimálně 12 hodin před punkcí nebo extrakcí epidurálního katétru a znovu profylaxi zahájit 4–6 hodin po punkci, pokud nebyla krvavá a/nebo obtížná (v tom případě 24 hod. po punkci) a minimálně 4–6 hodin po extrakci katétru (tab. 3; 18).
Tab. 3 Doporučené minimální intervaly před/po neuroaxiální punkci a zavádění/extrakci epidurálního katétru nebo manipulaci s epidurálním katétrem (modifikováno dle 18)
Přípravek ovlivňující hemokoagulaci
Interval před punkcí/extrakcí epidurálního katétru
Interval po punkci/extrakci epidurálního katétru
nefrakciovaný heparin, profylaktická dávka
4–6 hod.
1 hod.
nefrakciovaný heparin, terapeutická dávka
4–6 hod. i. v.
8–12 hod. s. c.
1 hod.
1 hod.
nízkomolekulární heparin, profylaktická dávka
12 hod.
4 hod.
nízkomolekulární heparin, terapeutická dávka
24 hod.
4 hod.
fondaparinux, profylaxe
36–42 hod.
6–12 hod.
rivaroxaban, profylaxe
22–26 hod.
4–6 hod.
apixaban, profylaxe
26–30 hod.
4–6 hod.
dabigatran, profylaxe
Dle SPC kontraindikován
6 hod.
klopidogrel
7 dní
Ihned
tiklopidin
10 dní
Ihned
prasugrel
7–10 dní
6 hod.
tikagrelor
5 dní
6 hod.
Příznaky expanze v páteřním kanálu jsou bolest v inervované oblasti, přetrvávající motorická blokáda, senzorický deficit a retence moči. Při podezření je třeba neprodleně provést diagnostické neurologické vyšetření a magnetickou rezonanci. Jediným terapeutickým řešením je provést do 6–8 hodin od vzniku příznaků dekompresní laminektomii. Po 14 hodinách od vzniku příznaků je paraplegie zpravidla ireverzibilní (19).
7 Multimodální analgezie
Při multimodální analgezii se kombinují metody místní a systémové analgezie, případně léky z různých skupin uvedených výše. Vhodné kombinace jsou mezi léky z různých skupin (příkladem je paracetamol + diklofenak ± orfenadrin + tramadol), zcela nevhodné jsou při nedostatečném účinku kombinace léků z téže skupiny (příklad ibuprofen + diklofenak).
8 Zodpovědnost za léčbu pooperační bolesti
Podobně jako celá péče o chirurgického pacienta je i pooperační analgezie multidisciplinární záležitostí (20). Poučení pacienta o jeho právech na adekvátní tišení bolesti a o způsobu měření intenzity bolesti by měli před operací provádět všichni zdravotníci. Konkrétní výběr postupu, poučení a získání souhlasu s invazivními metodami analgezie (nervové a neuroaxiální blokády) provádí nejčastěji anesteziolog. Během vlastní operace ovlivňuje kvalitu budoucí analgezie jak chirurg volbou operačního přístupu a délkou operace, tak anesteziolog výběrem vhodné techniky; pacient by po ukončení anestezie měl odjíždět s pocitem pouze mírné bolesti. V pooperačním období má zásadní roli ošetřující sestra a lékař, v případě kontinuálních lokoregionálních metod participuje též anesteziolog, případě tým pro léčbu akutní pooperační bolesti (20).
Ošetřující lékař: Předepisuje běžnou analgetickou terapii, sleduje její účinnost a reaguje na individuální potřeby pacienta, při nedostatečné analgezii může měnit dávkování, v případě bolesti nereagující ani na opakované zvýšení dávek opioidů nebo v případě vystupňovaných nežádoucích účinků konzultuje anesteziologa či tým pro léčbu bolesti.
Anesteziolog: Titruje léčbu, aby pacient opouštějící zotavovací místnost nebo její ekvivalent netrpěl významnou pooperační bolestí, podle domluvy s chirurgem může doporučit první dávku analgetika a provádět rozpis speciální analgetické léčby (pacientem kontrolovaná analgezie, lokoregionální metody) a péči o katétry zavedené k nervovým strukturám.
Sestra pooperačního oddělení: Měří a zaznamenává intenzitu pooperační bolesti, účinnost analgetické léčby, hodnoty základních vitálních funkcí a nežádoucí účinky analgetické léčby, v případě nedostatečné analgezie konzultuje ošetřujícího lékaře, v případě ohrožení vitálních funkcí (například zástava dechu po opioidech) postupuje podle protokolu.
Tým pro léčbu akutní pooperační bolesti (APS – acute pain service) zastřešuje léčbu v dané instituci. Mezi jeho úkoly patří vzdělávání zdrav. pracovníků a kontrola provádění analgetické terapie. Rutinní péči provádějí nelékařští zdravotničtí pracovníci (zdravotní sestry) v rámci 24hodinové služby. Sestra řeší běžné komplikace, extrahuje katétry, vede knihu zásahů APS a někdy připravuje analgetické směsi. Lékař poskytuje konziliární službu na žádost ošetřujícího lékaře v případě selhání standardních postupů nebo komplikací, doporučuje změnu postupu (při odchylce od doporučených standardů nebo konzilia lékaře APS přebírá zodpovědnost ten, kdo změnu učiní). Mimo pracovní dobu tuto činnost většinou zajišťuje anesteziolog ve službě.
9 Strategie léčby pooperační bolesti, nejčastější chyby
Jak bylo uvedeno na začátku, základem je měření intenzity bolesti a použití multimodální analgezie. Při mírné až střední bolesti lze používat neopioidní analgetika, případně při respektování kontraindikací nesteroidní analgetika, případně s adjuvanciemi (orfenadrin v případě spasmů kosterních svalů). U neopioidních analgetik a NSA je vhodné podávat léky v pravidelných intervalech. Při střední bolesti lze přidat slabý opioid (opět lze v pravidelných intervalech), ale při intenzivní bolesti je lékem první volby silný opioid. Neplatí tedy analgetický žebříček WHO pro léčbu onkologické bolesti, ale vždy začínáme silným opioidem v dostatečné dávce a tak, jak bolest ustupuje, můžeme dávku snižovat. V případě přetrvávající intenzivní bolesti i po uplynutí předpokládané doby nástupu účinku opioidu lze poloviční dávku zopakovat. Čekání s další dávkou až po uplynutí standardní doby účinku opioidu je v tomto případě chybou. Nástup účinku i výskyt nežádoucích účinků opioidů je nutné sledovat v pravidelných intervalech: po i. v. podání za 5–10 minut, po i. m. a s. c. podání za 30 minut, po p. o. podání za 45 minut.
Stále více pacientů užívá pro chronickou či nádorovou bolest dlouhodobě opioidy. Je nutné si uvědomit, že tyto léky jsou titrovány na jejich chronickou bolest, nikoliv na další bolest akutní. Lze předpokládat, že v důsledku tolerance budou mít v pooperačním období vyšší spotřebu opioidů a analgetik. Mají-li nalepené transdermální formy opioidů, léčba se nepřerušuje, jsou-li na perorální formě a nemohou pokračovat v terapii p. o., je nutné léky nahradit. Přepočet je zhruba takový, že parenterální dávka morfinu je třetinová ve srovnání s orální dávkou. Při podání antidota hrozí abstinenční syndrom.
Vhodné kombinace analgetik jsou léky z různých lékových skupin; nevhodné jsou látky ze stejné skupiny (viz kap. 4). Stejně nevhodné až nebezpečné je kombinovat opioidy podávané neuroaxiálně a systémově. Pokud je třeba při selhání neuroaxiální analgezie podat silný opioid systémově, pacient musí být na monitorovaném lůžku.
10 Závěr
Bolest je subjektivní prožitek a ve vnímání bolesti a spotřebě analgetik jsou výrazné interindividuální rozdíly. („Věřte pacientovi jeho bolest.“) Důležitá je správná volba analgetika: analgetika se liší účinností, nežádoucími účinky, možnostmi kombinace s dalšími analgetiky a adjuvanciemi, kontraindikacemi.
Základní principy pooperační analgezie jsou měření intenzity bolesti a reakce na získané údaje, včasné zahájení léčby (předoperačně, peroperačně, pooperačně), použití lokoregionálních metod a neopioidních analgetik, individualizování analgezie podle typů operačních výkonů a skupin pacientů a využití multimodální analgezie včetně fixních kombinací NSA při respektování jejich kontraindikací.
1. Berry P. H. et al. Pain: current understanding of assessment, management and treatments. National Pharmaceutical Council 2001 : 14, 21.
2. Steeds C. E. The anatomy and physiology of pain. 2019. Dostupné na: www.surgeryjournal.co.uk/article/S0263-9319(15)00236-7/pdf
3. Yam M. F., Loh Y. C., Tan C. S. et al. General pathways of pain sensation and the major neurotransmitters involved in pain regulation. Int J Mol Sci 2018, 19 (8), pii: E2164.
4. Ševčík P. Patofyziologie akutní pooperační bolesti. In: Málek J., Ševčík P. a kol. Léčba pooperační bolesti (3. vyd.). Mladá fronta, Praha, 2014 : 15–20.
5. McNicol E. D., Ferguson M. C., Hudcová J. Patient controlled opioid analgesia versus non-patient controlled opioid analgesia for postoperative pain. Cochrane Database Syst Rev 2015; 6: CD003348.
6. Morriss W., Goucke R., Huggins L. EPM Lite Instructor Manual 1st Edition 2015. Dostupné na: www.rcoa.ac.uk/sites/default/files/images/FPM-EPM-Lite-Instructor-Manual-Final.pdf
7. Opavský J. Specifika a rozdíly ve vyšetřování a v přístupu k pacientům s akutní nebo chronickou bolestí. Medicína pro praxi 2010; 7 (2): 76–79.
8. Mixa V. Pooperační analgezie u dětí. In: Málek J. a kol. Praktická anesteziologie (2., přepracované a doplněné vyd.). Grada, Praha, 2016 : 94–110.
9. Ip H. Y., Abrishami A., Peng P. W. et al. Predictors of postoperative pain and analgesic consumption: a qualitative systematic review. Anesthesiology 2009; 111 : 657–677.
10. Málek J., Mach D. Pooperační analgezie. In: Málek J., Ševčík P. a kol. Léčba pooperační bolesti (3. vyd.). Mladá fronta, Praha, 2014 : 30–84
11. Amraoui J., Pouliquen C., Fraisse J. et al. Effects of a hypnosis session before general anesthesia on postoperative outcomes in patients who underwent minor breast cancer surgery: the HYPNOSEIN randomized clinical trial. JAMA Netw Open 2018; 1 (4): e181164.
12. Wager T., Atlas L. The neuroscience of placebo effects: connecting context, learning and health Nat Rev Neurosci 2015; 16 (7): 403–418.
13. Knor J., Málek J. Cesty podání léků. In: Knor J., Málek J. Farmakoterapie urgentních stavů (3., doplněné a rozšířené vyd.). Maxdorf, Praha, 2019 : 3–38.
14. SPC jednotlivých látek. Dostupné na: www.sukl.cz
15. Hernandez I., He M., Brooks M. M., Zhang Y. Exposure-response association between concurrent opioid and benzodiazepine use and risk of opioid-related overdose in Medicare Part D beneficiaries. JAMA Network Open 2018; 1 (2): e180919.
16. Vymazal T., Urbánek K. Léčba bolesti fixní kombinací orfenadrinu a diklofenaku. Klinická farmakologie a farmacie 2018; 32 (3): 26–33.
17. Horáček M. Lokální anestetika. In: Málek J. a kol. Praktická anesteziologie (2., přepracované a doplněné vyd.). Grada, Praha, 2016 : 52–70.
18. Gogarten W., Vandermeulen E., Van Aken H. et al. Regional anaesthesia and antithrombotic agents: recommendations of the European Society of Anaesthesiology. Eur J Anaesthesiol 2010; 27 (12): 999–1015.
19. Mach D. Komplikace při lokoregionální anestezii. In: Málek J. a kol. Praktická anesteziologie. 2. přepracované a doplněné vydání. Grada, Praha, 2016 : 139–143.
20. Bejšovec D., Gabrhelík T., Kubricht V. Organizace léčby pooperační bolesti. In: Málek J., Ševčík P. a kol. Léčba pooperační bolesti (3. vyd.). Mladá fronta, Praha, 2014 : 125–133.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



