-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Klinický význam parametru CAVI (Cardio‑ Ankle Vascular Index) v prevenci, diagnostice a terapii
Clinical significance of the parameter CAVI (Cardio ‑ Ankle Vascular Index) in prevention, diagnosis and therapy
Loss of elasticity of the arterial wall accompanied by its stiffening has been identified as an independent prognostic factor in patients with cardiovascular diseases. The standard non‑invasive investigation of arterial stiffness is the measurement of pulse ‑ wave velocity (PWV), but its accuracy is affected by changes in blood pressure (BP) at the time of measurement. Because an exponential relationship exists between intravascular pressure and diameter of the artery, an arterial wall stiffness parameter β can be defined using the natural logarithm of the ratio of systolic and diastolic blood pressure and the elasticity of the arterial wall. Parameter β is the basis for the calculation of CAVI (Cardio ‑ Ankle Vascular Index), which is independent of changes in BP. This is a big advantage of CAVI, which has been the subject of intense clinical research in the past decade, focusing on the evaluation of arterial stiffness in patients with existing cardiovascular disease and also in patients at increased risk, such as those with hypertension, diabetes or obesity. The primary objective of the diagnostic use of CAVI is the assessment of arterial stiffness and early detection of atherosclerosis. CAVI can be successfully used for monitoring the possible progression of the disease and effectiveness of treatment. Nevertheless, it is recommended that the CAVI measurement is evaluated with some caution because its elevated values reflect vascular stiffness induced by pathological mechanisms in the arterial wall, as well as the increased arterial tension resulting from smooth muscle contractions.
Keywords:
Cardio ‑ Ankle Vascular Index – arterial stiffness – cardiovascular diseases – atherosclerosis
Autoři: P. Dobšák 1; V. Soška 2; T. Šrámková 3; L. Mífková 1; V. Mrkvicová 1; P. Palanová 1; J. Siegelová 1,4; K. Shirai 5
Působiště autorů: Klinika tělovýchovného lékařství a rehabilitace LF MU a FN u sv. Anny v Brně 1; Oddělení klinické biochemie, FN u sv. Anny v Brně 2; Sexuologický ústav, 1. LF UK a VFN v Praze 3; Katedra fyzioterapie a rehabilitace, LF MU, Brno5 Sakura Hospital, Medical Center, Toho University, Japonsko 4
Vyšlo v časopise: Kardiol Rev Int Med 2014, 16(4): 272-279
Kategorie: Kardiologická revue
Souhrn
Ztráta elasticity arteriální stěny provázená její zvýšenou tuhostí byla identifikována jako nezávislý prognostický faktor u pacientů s kardiovaskulárními chorobami. Standardním neinvazivním způsobem vyšetřování arteriální tuhosti je měření rychlosti pulzové vlny (pulse ‑ wave velocity – PWV), avšak jeho přesnost je ovlivněna změnami krevního tlaku (TK) v okamžiku měření. Protože mezi intravaskulárním tlakem a průměrem arterie existuje exponenciální vztah, lze definovat pomocí přirozeného logaritmu poměru systolického a diastolického tlaku a elasticity arteriální stěny tzv. parametr tuhosti tepenné stěny β. Parametr β je základem pro výpočet CAVI (Cardio ‑ Ankle Vascular Index), který je nezávislý na změnách TK. To představuje velkou výhodu CAVI, který byl v uplynulé dekádě předmětem intenzivního klinického výzkumu zaměřeného na hodnocení tuhosti tepen u pacientů s již existujícími kardiovaskulárními chorobami a také u osob se zvýšeným rizikem, např. s hypertenzí, diabetem nebo obezitou. Prvořadým cílem diagnostického využití CAVI je posouzení tepenné tuhosti a včasného záchytu aterosklerózy. CAVI je možné s úspěchem využít při monitorování případné progrese nemoci a také účinnosti nastavené léčby. Při konečném hodnocení CAVI se však doporučuje jistá opatrnost, neboť jeho zvýšené hodnoty odrážejí jak cévní tuhost vyvolanou patologickými mechanizmy v arteriální stěně, tak i stav zvýšeného tepenného napětí následkem kontrakce hladké svaloviny.
Klíčová slova:
Cardio ‑ Ankle Vascular Index – tepenná tuhost – kardiovaskulární choroby – aterosklerózaÚvod
Kardiovaskulární choroby jsou hlavní příčinou úmrtí v rozvinutých zemích. Je to následek progrese aterosklerózy, chronického onemocnění kardiovaskulárního systému, které se vyvíjí řadu let bez klinických příznaků až do okamžiku, kdy dojde k radikálnímu zúžení tepny nebo ke vzniku akutního bloku krevní cirkulace. Progrese aterosklerózy může být zpomalena, zastavena nebo dokonce zvrácena pomocí intenzivní léčby hlavních kardiovaskulárních rizikových faktorů, zejména agresivními postupy pro snížení hladiny cholesterolu. Například intenzivní léčba statiny může vést jak k redukci aterosklerotických plaků, tak i ke snížené incidenci ischemické choroby srdeční (ICHS) či cévních mozkových příhod (CMP) [1,2]. Proto je problematika včasné detekce iniciálních aterosklerotických změn pomocí jednoduchého, kvantitativního a neinvazivního vyšetření velmi důležitá z důvodů prevence budoucích, klinicky významných kardiovaskulárních příhod. Rozšířenou diagnostickou metodu představuje např. měření tloušťky komplexu intima ‑ media karotických arterií (CIMT) ultrazvukem s vysokým stupněm rozlišení. Tato tloušťka je považována za důležitý prediktor kardiovaskulárních příhod [3,4]. Tzv. „tuhost“ tepny je závislá na jejích elastických vlastnostech. Velmi rozšířeným způsobem neinvazivního vyšetření tuhosti velkých tepen je měření rychlosti šíření pulzní vlny ve směru paže – kotníky (brachial ‑ ankle pulse wave velocity – baPWV) [5,6]. Parametr baPWV roste se zvyšující se tuhostí arteriální stěny a umožňuje posouzení stavu jak u tepen centrálních (elastických), tak periferních (muskulárních). Bylo prokázáno, že PWV je významným prediktorem ischemické choroby srdeční, který může sloužit jako prognostický faktor akutního koronárního syndromu [7]. Přesto však existuje několik limitací, které snižují význam využití PWV v klinické praxi. Ačkoli se za hlavní kauzální faktor zvýšené arteriální tuhosti považuje ateroskleróza, bylo prokázáno, že neexistuje žádná signifikantní korelace mezi PWV a rizikovými faktory pro její vývoj, s výjimkou věku a krevního tlaku [8]. Mimo to PWV reflektuje aterosklerotický proces až v pokročilejších fázích (např. po vzniku sekundárních kalcifikací v plaku) a nikoli časné patologické změny [9]. Jako další limitace vyšetření PWV uvádí odborná literatura poměrně nízkou reprodukovatelnost výsledků, složitost techniky záznamu a riziko ovlivnění výsledků změnami krevního tlaku (TK) v době měření [10]. Z výše uvedených důvodů byly v nedávné minulosti zkoumány další diagnostické možnosti pro včasnou detekci aterosklerózy. V roce 2004 tak byl do klinické praxe zaveden nový neinvazivní screeningový nástroj pro detekci časných změn tepenné tuhosti – tzv. parametr CAVI (Cardio ‑ Ankle Vascular Index) [10,11]. V průběhu poslední dekády prokázalo množství převážně zahraničních studií užitečnost stanovení CAVI pro včasnou diagnostiku aterosklerózy [12 – 14]. Kromě toho byly publikovány výsledky měření CAVI u pacientů s obezitou, metabolickým syndromem, esenciální hypertenzí a u osob se zvýšeným kardiovaskulárním rizikem [15,16].
Cardio ‑ Ankle Vascular Index (CAVI)
Princip matematického odvození CAVI a podrobné technické specifikace jsou podrobně popsány v příslušné odborné literatuře [17], proto následující text uvádí pouze výběr nejdůležitějších informací (obr. 1).
Obr. 1. Schematické znázornění principu měření parametru CAVI, který refl ektuje tuhost aorty, femorálních a tibiálních tepen jako jednoho celku ve směru srdce – kotníky. Publikováno se souhlasem autora [11]. ![Schematické znázornění principu měření parametru CAVI, který refl ektuje tuhost aorty, femorálních a tibiálních tepen jako jednoho celku ve směru srdce – kotníky. Publikováno se souhlasem autora [11].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d517652d20856e10bd541e4cd3b4372f.jpg)
V současné době je standardním přístrojem pro měření CAVI model VaSera® VS 1000 nebo VS 1500 (Fukuda ‑ Denshi Co. Ltd., Tokio, Japonsko), který využívá zcela novou sofistikovanou oscilometrickou technologii [18]. VaSera® je přenosný přístroj o rozměrech 34,6 cm (š) × 24,0 cm (d) × 15,4 cm (v) a hmotnosti 7,2 kg s možností barevného tisku a paměťovou kapacitou na 3 000 vyšetření. Vyšetření se provádí v supinační poloze, na všechny čtyři končetiny se umístí tlakové manžety, nad horní okraj sterna jeden snímací mikrofon (fonokardiogram) a na obě horní končetiny dva EKG svody. Výpočet CAVI provádí software přístroje automaticky dle vzorce [18]:
CAVI = a [{2ρ × 1/ (STK – DTK)}× {In (STK/ DTK) × PWV2}] + b
(ρ – hustota krve; a, b – konstanty, PWV – pulse wave velocity, STK – systolický krevní tlak, DTK – diastolický krevní tlak).
Z důvodu snížení rušivých zevních vlivů na dynamiku krevního průtoku, které vznikají při nafukování manžet, se záznam pulzní vlny provádí v okamžiku, kdy je hodnota tlaku v manžetách nižší než tlak diastolický (tj. 50 mm Hg). Hodnoty STK, DTK a pulzního tlaku (PP) se získávají ze záznamu krevního tlaku na pravé a. brachialis. Součástí vyšetření je rovněž měření dalšího cévního indexu, tzv. ABI (Ankle ‑ Brachial Index), který odráží pouze stav periferních tepen. Dle firemních údajů přístrojem VaSera® je možné dosáhnout 3,8 % průměrného variačního koeficientu mezi pěti opakovanými měřeními. Jak vyplynulo z dosud publikovaných klinických i experimentálních studií, CAVI není – na rozdíl od PWV – závislý na hodnotě krevního tlaku v okamžiku měření [19 – 21]. Shirai et al srovnávali akutní účinek několika farmak ovlivňujících krevní tlak [22]. Po aplikaci metoprololu (velmi účinný blokátor β1‑adrenergních receptorů) byly následujících 6 hod pravidelně měřeny hodnoty TK, CAVI a baPWV. Došlo k signifikantnímu snížení průměrné hodnoty STK ze 131,4 na 118,3 mm Hg (p < 0,05) a průměrné hodnoty DTK z 85,3 na 75,3 mm Hg (p < 0,05). Signifikantně se snížila také hodnota baPWV (z 13,9 na 12,5 m.s – 1; p < 0,05), avšak parametr CAVI zůstal stabilní (8,2 vs 8,2; NS). Podobné výsledky potvrzující nezávislost CAVI na krevním tlaku přinesl i test s doxazosinem (α1‑adrenergní blokátor).
Referenční hodnoty CAVI
Pro stanovení základních referenčních hodnot CAVI byla v Japonsku provedena rozsáhlá studie u více než 32 000 osob obou pohlaví ve věku 20 – 79 let bez kardiovaskulárního onemocnění a bez rizikových faktorů [23]. U mužů ve věku 20 – 70 let se CAVI zvyšoval s věkem téměř lineárně. Průměrné hodnoty CAVI byly u mužů vyšší než u žen téměř ve všech věkových skupinách, avšak oba soubory mužů a žen vykazovaly podobnou míru zvyšování CAVI v průměru o 0,5 za 1 rok (graf 1).
Graf 1. Graf závislosti CAVI na věku a pohlaví. Publikováno se souhlasem autora [18]. ![Graf závislosti CAVI na věku a pohlaví. Publikováno se souhlasem autora [18].](https://pl-master.mdcdn.cz/media/image/00ae2884e43defeb2e36e6606b7827ed.jpg?version=1537791955)
Součástí studie bylo i porovnání vlivu různých kardiovaskulárních patologií (např. ICHS, hypertenze, cévní mozkové příhody, diabetes mellitus, renální insuficience aj.) na výsledné hodnoty CAVI. Studie dospěla k závěru, že průměrné skóre CAVI u bezrizikové populace lze akceptovat jako normální referenční hodnoty využitelné v klinické praxi a že CAVI může být významným nástrojem pro screening osob s různě pokročilým stupněm aterosklerózy. V souladu s tímto závěrem byla stanovena hodnota CAVI < 8,0 jako normální (fyziologický) nález. Hodnoty v rozmezí < 9,0 – 8,0 jsou považovány za „hraniční“ a CAVI ≥ 9,0 může být vážným signálem přítomnosti kardiovaskulárního onemocnění [24]. V této souvislosti je třeba upozornit na důležitost stanovení referenčních hodnot CAVI v jiných než asijských populacích a vzhledem k úzkému vztahu mezi CAVI a věkem bude nezbytné získané výsledky na věk adjustovat.
Limitující faktory měření CAVI
Řada autorů upozorňuje na skutečnost, že CAVI odráží jak organickou, tak i funkční tuhost tepenné stěny, a proto jej nelze považovat za čistý ukazatel organických změn v arteriální stěně vlivem aterosklerózy či stárnutí [22]. Index je sice na tlaku nezávislý, avšak je významně ovlivněn stavem hladké svaloviny v tepnách, což se projevuje ve změnách tepenného tonusu [25]. Z tohoto důvodu je zcela na místě určitá opatrnost při interpretaci výsledných dat (na druhé straně je však růst sympatikotonie charakteristickým znakem řady patologických stavů, např. rezistentní hypertenze nebo srdečního selhání, a v takových případech může být měření CAVI nepochybně výhodné) [26]. Je pozoruhodné, že zatímco vyšší CAVI je všeobecně považováno za patologický nález, jeho snížená hodnota nemusí nutně reprezentovat bezproblémovou funkci tepen a může být patognomická pro některé choroby. Například bylo zjištěno, že existuje negativní korelace mezi CAVI a sérovým IGF‑1, jehož plazmatická hladina roste u akromegalických pacientů [27], a autoři studie proto došli k závěru, že CAVI může být užitečným nástrojem pro posouzení účinnosti terapeutických výsledků. Mimo to, CAVI nelze hodnotit v případě nízkých hodnot indexu ABI(< 0,9). Pacienti s ABI < 0,9 mohou mít rozsáhlé aterosklerotické změny na periferních tepnách dolních končetin, a výsledek měření CAVI tak není validní [11]. Za těchto okolností je třeba zvolit jiné neinvazivní postupy vyšetření tepenné funkce, např. konvenční nebo modifikované měření PWV [28], popřípadě též vyhodnocení vaskulární endoteliální funkce pomocí FMD (flow ‑ mediated dilation) [29].
Klinické a experimentální aplikace CAVI
Od svého prvního uvedení v roce 2004 je parametr CAVI široce využíván v různých klinických studiích [30]. Převážnou většinu tvoří ty, které se zabývají posouzením arteriální tuhosti u pacientů s již diagnostikovanými kardiovaskulárními chorobami nebo u osob se zvýšeným kardiovaskulárním rizikem (obr. 2).
Obr. 2. Přehled faktorů zvyšujících nebo snižujících hodnotu CAVI. 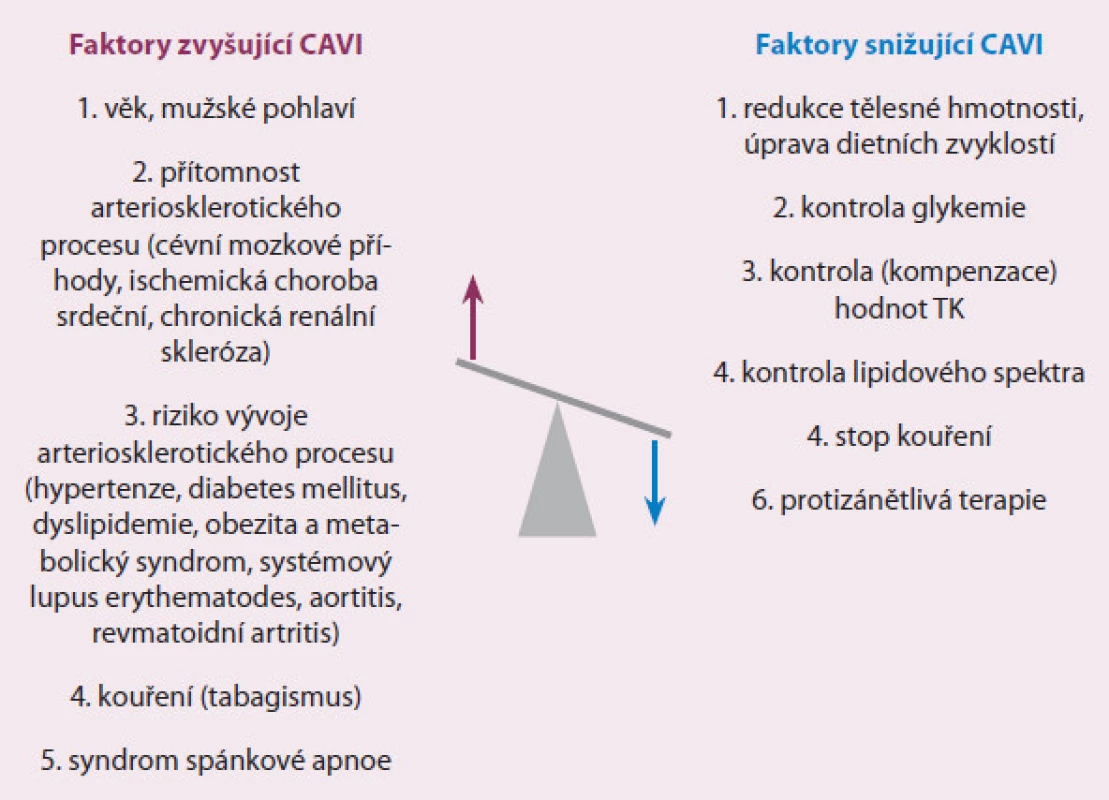
CAVI a kardiovaskulární choroby
Prokázat, že CAVI je ukazatelem stupně aterosklerózy, není snadný úkol, protože kvantitativní hodnocení aterosklerózy je in vivo obtížné. Z tohoto důvodu bylo provedeno srovnání morfologie aorty u několika osob, u nichž bylo CAVI změřeno během života [18]. Obr. 3 ukazuje dva typické příklady.
Obr. 3. Morfologický obraz (post mortem) vnitřní plochy aorty u dvou pacientů. Publikováno se souhlasem autora [18]. ![Morfologický obraz (post mortem) vnitřní plochy aorty u dvou pacientů. Publikováno se souhlasem autora [18].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f949e20a887087122236d8d15740dc82.jpg)
Morfologie aorty post mortem u ženy ve věku 50 let vykazuje pouze nepatrné aterosklerotické změny, což odpovídá hodnotě CAVI (= 7,3) naměřené za jejího života. Naproti tomu aorta muže ve věku 76 let nese jasné známky těžkého poškození, které odpovídá pokročilému stadiu aterosklerózy a také velmi vysokému CAVI (= 11,0) (jak bylo uvedeno výše, za signál přítomnosti aterosklerózy se pokládá hodnota ≥ 9,0).
Není třeba podrobně rozebírat notoricky známý fakt, že ICHS je nejvíce rozšířenou, život ohrožující patologií tzv. industriálního světa. Bylo prokázáno, že CAVI odráží stupeň aterosklerotického postižení koronárních tepen u pacientů s potvrzenou diagnózou ICHS [31,32]. Kromě toho se ukázalo, že CAVI je nezávislý parametr pozitivně korelující s tzv. kalciovým skóre koronárních tepen (coronary artery calcium score – CACS) a také se stupněm stenózy reflektujícím přítomnost koronární aterosklerózy u asymptomatických jedinců s abnormálním glycidovým metabolizmem [33]. Klinický význam CAVI u pacientů s ICHS byl dále potvrzen objevem jeho úzké vazby na hodnotu tzv. SYNTAX skóre (prognostický ukazatel u pacientů s akutním koronárním syndromem mapující rozsah postižení koronárních tepen aterosklerózou [34]. Dosavadní výsledky klinického testování tedy naznačují, že CAVI může být nejen užitečným nástrojem pro posouzení progrese plaku v koronárním systému u pacientů s prokázanou ICHS [31,32], ale také prognostickým faktorem rizika vývoje subklinické koronární aterosklerózy u asymptomatických jedinců [33,34]. Navíc se CAVI ve srovnání s baPWV jeví jako podstatně významnější klinický parametr, protože má vysoký stupeň korelace s funkcí levé komory a plazmatickou hladinou lipidů [20]. To vše potvrzuje význam měření a hodnocení CAVI v rámci diagnostické a terapeutické strategie v kardiologii.
CAVI a cerebrovaskulární choroby
Nemoci cerebrovaskulárního systému jsou dalším velmi rozšířeným patologickým procesem v průmyslových zemích. Ukázalo se, že pomocí CAVI lze detekovat i diskrétní či subklinické formy intrakraniálních cévních patologií, např. u pacientů s akutní ischemickou CMP [35]. Bylo také prokázáno, že CAVI nezávisle koreluje s tzv. tichým mozkovým infarktem [36]. Také některé chorobné procesy postihující menší mozkové tepny u asymptomatických osob mladého a středního věku významně ovlivňují výsledné hodnoty CAVI [37]. Pozoruhodnou skutečností je rovněž úspěšné využití CAVI pro hodnocení cévní stabilizace vlivem intenzivního rehabilitačního programu u pacientů po CMP [38].
CAVI a hypertenze
Hypertenze je jednoznačně jedním z nejčastěji se vyskytujících patologických stavů spojených se zvýšenou cévní tuhostí. Pro tuto skutečnost svědčí velké množství odborné literatury zabývající se problematikou CAVI u hypertoniků. Byly prokázány pozitivní korelace CAVI s řadou provokačních faktorů, např. hladinou zánětlivých markerů nebo oxidačním stresem [15,39,40]. U pacientů s hypertenzí může být CAVI indikátorem dysfunkce levé komory a poškození dalších orgánových systémů [41,42]. Kromě toho lze CAVI využívat pro vyšetřování jedinců s vysokým rizikem vzniku hypertenze, což se potvrdilo např. při diferenciální diagnostice preeklamptických stavů a chronické hypertenze u gravidních žen [43]. Na základě doposud získaných poznatků byl CAVI v některých zemích akceptován jako nástroj pro posouzení účinnosti terapeutických postupů u hypertonických pacientů [44,45]. Pomocí CAVI bylo rovněž provedeno hodnocení léčebného potenciálu alternativních intervencí u hypertenze [46].
CAVI a diabetes mellitus
Diabetes mellitus je patologií, u níž je zvýšení tepenné tuhosti pravidlem. Podařilo se prokázat, že pomocí CAVI lze velmi citlivě zachytit rozvoj komplikací spojených s diabetem. Diabetická periferní neuropatie významně zvyšuje CAVI, a to bez průvodních změn v karotické intimě u pacientů s diabetem 2. typu [47]. Navíc se ukázalo, že ve srovnání s baPWV parametr CAVI lépe odráží stav kompenzace diabetu [21]. Vysoké hodnoty CAVI také úzce korelují s mírou mikroalbuminurie u diabetu 2. typu [48], což ještě více podtrhuje mimořádnou schopnost CAVI detekovat diabetické mikrovaskulární komplikace. Kromě toho, že CAVI významně koreluje s délkou trvání diabetu, souvisí rovněž velmi úzce s plazmatickou hladinou reaktantů akutní fáze, včetně C ‑ reaktivního proteinu, amyloidu, kyseliny sialové či fibrinogenu, což jsou známé iniciační faktory aterosklerózy u pacientů s diabetem 2. typu [49]. Podobně jako u dalších patologických stavů, i v případě diabetu je CAVI používán pro posuzování účinnosti farmakologických postupů u pacientů s diabetem 2. typu [50].
CAVI a dyslipidemie
LDL cholesterol je považován za silný proaterogenní faktor a některé studie prokázaly zvýšené hodnoty CAVI u osob s hyperlipidemií [23,51]. V této souvislosti je potěšující, že v záplavě asijských výzkumných prací se postupně objevují také zkušenosti s klinickou aplikací CAVI u českých pacientů. Soška et al zjistili, že CAVI nemusí být nezbytně vysoký u heterogenní familiární hypercholesterolemie [52]. Iniciální stadia aterosklerózy u hypercholesterolemie jsou provázené tvorbou tukových proužků v intimě (tzv. fatty streaks). V této fázi však není tepenná tuhost podstatně zvýšená a CAVI může dosahovat normálních hodnot, avšak v důsledku progrese se rozvíjí chronická zánětlivá reakce a tuhost tepny roste. Terapie pitavastatinem CAVI snižuje, protože – kromě jiného – tento statin zvyšuje syntézu NO v endoteliálních buňkách, a to může být jedním z důvodů poklesu tepenné tuhosti [53].
CAVI a metabolický syndrom
Obezita a metabolický syndrom mají v současnosti charakter globální epidemie. Viscerální akumulace tuku podmiňuje vznik inzulinové rezistence, hypertenze a dyslipidemie. Vysoký CAVI typicky provází jak obezitu, tak i metabolický syndrom, a pozitivně koreluje s obvodem pasu i počtem jednotlivých symptomů [54]. Redukce hmotnosti může zlepšit příznaky metabolického syndromu, což potvrzují výsledky tříměsíčního kondičního tréninku a dietních opatření, po nichž se hodnota CAVI výrazně snížila [16]. V této souvislosti je třeba také zmínit fakt, že CAVI odráží pozitivní terapeutický vliv potravinových doplňků na cévní systém u obézních osob [55].
CAVI a syndrom spánkové apnoe
Epizody spánkové apnoe (SA) představují značnou zátěž pro vaskulární systém v důsledku opakovaných výkyvů hladiny kyslíku. Nedávno publikovaná studie zabývající se zvýšeným kardiovaskulárním rizikem u pacientů s obstrukční SA prokázala, že plazmatická hladina pentraxinu 3 (prozánětlivý indikátor) nezávisle koreluje s hodnotou CAVI [56]. CAVI je obecně u nemocných s diagnostikovanou SA vysoký [57], avšak vlivem příslušných terapeutických opatření (CPAP) jeho hodnota klesá [58].
CAVI a chronické renální selhání
Vzhledem k tomu, že kardiovaskulární komplikace jsou hlavní příčinou úmrtí u chronických nemocí ledvin, je třeba považovat monitorování arteriální tuhosti za důležitý nástroj zjišťování přítomnosti a progrese kardiovaskulárních komplikací u těchto pacientů. Protože zvýšení TK je častým nálezem u většiny pacientů s onemocněním ledvin, může být měření CAVI metodikou volby, a to právě díky své nezávislosti na změnách TK v okamžiku měření (na rozdíl od konvenčního měření pomocí baPWV). Ze závěrů japonské studie provedené u chronicky hemodialyzovaných pacientů vyplynulo, že skóre CAVI nad 7,55 svědčí o přítomnosti kardiovaskulárního onemocnění [59]. Z tohoto pohledu je možné CAVI používat jako screeningový parametr pro monitoring efektivity následné léčby. CAVI našel uplatnění také jako úspěšný diagnostický nástroj u hemodialyzovaných pacientů s diastolickou dysfunkcí [60].
CAVI a zánětlivá onemocnění tepen
Vysoké hodnoty CAVI byly nalezeny u nemocných se systémovým lupus erythematodes (SLE) [61]. Kume et al zjistili vysoký CAVI u pacientů s revmatoidní artritidou a jeho následný pokles vlivem farmakoterapie [62].
CAVI a tabagismus
Kouření představuje vysoce rizikový iniciační faktor vzniku aterosklerózy. Hodnoty CAVI jsou u kuřáků vysoké, avšak stop kouření snižuje CAVI již v úvodních fázích a tento pokles je výraznější v průběhu následujících měsíců [63,64]. Měření CAVI by tedy mohlo být silným motivačním prvkem pro jedince, kteří se snaží s kouřením skončit.
CAVI a erektilní dysfunkce
Faktory, které zvyšují CAVI, jako je věk, mužské pohlaví, hypertenze, diabetes mellitus, dyslipidemie, obezita, metabolický syndrom, ICHS, CMP, kouření, syndrom spánkové apnoe, jsou současně rizikové faktory vedoucí k erektilní dysfunkci (ED). Faktory snižující CAVI – redukce váhy, kontrola glykemie, kompenzace hodnot TK, stop kouření – vedou ke zlepšení erektilní funkce. Nemocní s ED jsou často nositeli KVO. Vyšetření CAVI představuje pro muže s ED neinvazivní, šetrnou diagnostickou metodu pro screening možné aterosklerózy, ale i nástroj pro posouzení účinnosti terapeutických postupů a změny životního stylu.
CAVI a věk
Mimo výše zmíněné patologické procesy jako hypertenze nebo diabetes jsou procesy stárnutí organizmu dobře známým faktorem významně zvyšujícím CAVI [65,66]. Všeobecně se předpokládá, že růst hodnot pulzního tlaku vlivem věku je hlavní příčinou zvýšeného počtu na věku závislé hypertenze v důsledku stoupající tepenné tuhosti [67]. Studiem vlivu věku na růst arteriální tuhosti bylo prokázáno, že se tento proces týká spíše hlavních (centrálních) tepen než periferních [68,69]. Současně byly identifikovány patofyziologické mechanizmy, které přispívají k rozvoji arteriální tuhosti. Tyto mechanizmy jsou však odlišné jak u aterosklerózy, tak při procesech stárnutí. U aterosklerózy se jedná o převážné postižení arteriální intimy s výsledným zvýšením tloušťky stěny a tvorbou aterosklerotických plaků, zatímco vlivy stárnutí jsou projevem degenerace elastických vláken a masivní kolagenizace a kalcifikace [70,71]. Výsledky již citované japonské populační studie hodnotící výsledky měření CAVI u 32 000 zdravých osob obou pohlaví také ukázaly, že počet tzv. bezrizikových jedinců klesá se zvyšujícím se věkem [24]. Dále tato studie prokázala, že průměrné skóre CAVI bylo signifikantně vyšší u osob nad 40 let obou pohlaví s vysokým stupněm kardiovaskulárního rizika než u skupiny bezrizikové [24]. Další práce ukázala, že vlivem celkové anestezie nedochází k významnému poklesu CAVI u jedinců starších 65 let ve srovnání s jejich mladšími protějšky [72]. Protože CAVI je ovlivněn změnami vaskulární tonicity, jsou omezené schopnosti relaxace arteriální stěny s největší pravděpodobností projevem procesů sklerotizace arteriální stěny vlivem stárnutí [73]. Tématem CAVI a stárnutí se zabývaly také další klinické studie, zejména z hlediska významu pro rehabilitaci a pracovní lékařství [74,75].
CAVI a budoucí vývoj
Dle aktuálních údajů z nejvýznamnějších vědeckých databází vykazuje počet publikací týkajících se CAVI v posledních několika letech trvale vzestupný trend, přičemž je oceňována především jeho spolehlivost při posuzování arteriální tuhosti. Zvýšení počtu literárních údajů je v přímé souvislosti se stále intenzivnějším využíváním CAVI nejen v rámci hodnocení vaskulárních funkcí u pacientů s již diagnostikovaným onemocněním kardiovaskulárního systému nebo u asymptomatických jedinců se zvýšeným rizikem, ale také u jiných chorobných procesů, u nichž tuhost tepen stoupá již v časných fázích. Mimo to se aplikační spektrum dále rozšiřuje o studium vlivu zatím nespecifikovaných kardiovaskulárních vlivů na zdravé osoby. Ve srovnání s podobnými neinvazivními diagnostickými metodami reflektuje CAVI diskrétní rozdíly již na metabolické [21,54] či celulární úrovni [76]. Není proto překvapivé, že tento index může být úspěšně používán v obecné populaci pro detekci a posouzení závažnosti subklinických tepenných abnormit. Již několikrát zmíněná nezávislost CAVI na TK je unikátní předností, která významně rozšiřuje spektrum klinického využití. V této souvislosti je třeba zmínit význam CAVI pro studium tepenné tuhosti tepen různých etnik, protože drtivá většina doposud publikovaných studií o CAVI je asijského původu, a to zejména díky aktivitě japonských týmů. Studie provedená u 200 zdravých Japonců a stejného počtu ruských protějšků prokázala signifikantně zvýšenou CAVI u subjektů ruské národnosti [77]. Ačkoli se zde nabízí vcelku logický závěr, že vzorek ruské populace byl vystaven zvýšenému kardiovaskulárnímu riziku (díky obecně vyšší prevalenci těchto onemocnění v Ruské federaci ve srovnání s Japonskem), je třeba vzít v úvahu [77] také možný vliv antropometrických a genetických variací daných etnickým původem na výsledky měření CAVI. Na možnost existence geneticky podmíněné vnímavosti vůči kardiovaskulárním onemocněním u různých etnických skupin upozorňují i další publikace [78,79]. Za předpokladu existence možných rozdílů v měření CAVI daných etnickým původem [23,78 – 80] bude zásadně důležité vytvořit spolehlivé databáze referenčních hodnot prostřednictvím realizace velkých klinických studií u osob neasijského původu. Až poté bude možné považovat parametr CAVI za spolehlivý diagnostický nástroj hodnocení arteriální tuhosti v globálním měřítku. Význam tohoto konstatování stoupá zejména díky skutečnosti, že tzv. západní industrializované země mají podstatně vyšší kardiovaskulární mortalitu ve srovnání s japonskou populací, pro kterou již normohodnoty CAVI vytvořeny byly [23]. Případné globální akceptování CAVI jako spolehlivého neinvazivního způsobu včasné identifikace kardiovaskulárního rizika či onemocnění může být opravdovým průlomem v oblasti preventivní medicíny. Patologické změny by byly podchyceny již v raném stadiu, což by umožnilo včasnou intervenci a motivaci ke změně životního stylu [81]. Kromě toho u pacientů s prokázaným kardiovaskulárním onemocněním může být CAVI důležitým nástrojem monitorování následné progrese chorobného procesu [62] a efektivity prováděných terapeutických opatření [38,82,83].
Závěr
Od svého vzniku až do současnosti je parametr CAVI předmětem rozsáhlého klinického testování jak u tisíců pacientů s prokázaným kardiovaskulárním onemocnění (včetně aterosklerózy, ICHS či CMP), tak u osob se zvýšeným rizikem, tj. s vysokým krevním tlakem, diabetem či obezitou. Vycházíme‑li z předpokladu, že CAVI dostatečně citlivě detekuje časné funkční i organické změny ve velkých tepnách ještě před vznikem poškození většího rozsahu, může být právem považován za neocenitelný diagnostický prostředek preventivní medicíny. Nejenže jej lze doporučit pro kvantitativní posouzení rozsahu aterosklerózy velkých tepen u osob s prokázanou tepennou patologií, ale také jako screeningový nástroj pro vyšetřování jedinců v subklinickém stadiu postižení. Primárním cílem hodnocení tepenné tuhosti pomocí CAVI zůstává i nadále časná detekce aterosklerózy, což má zásadní význam pro včasnou terapeutickou intervenci a změnu životních zvyklostí. Navíc CAVI umožňuje také kvantitativní posouzení progrese nemoci a efektivitu léčby. Vezmeme‑li v úvahu, že první relevantní databáze referenčních hodnot CAVI pro asijskou populaci byla vytvořena poměrně nedávno (v roce 2011), je téměř jisté, že klinický výzkum CAVI bude mít vysokou prioritu i v příštích letech.
Doručeno do redakce: 13. 6. 2014
Přijato po recenzi: 14. 7. 2014
prof. MUDr. Petr Dobšák, CSc.
www.fnusa.cz
petr.dobsak@fnusa.cz
Zdroje
1. Collins R, Armitage J, Parish S et al. MRC/ BHF Heart Protection Study of cholesterol ‑ lowering with simvastatin in 5963 people with diabetes: a randomised placebo ‑ controlled trial. Lancet 2003; 361 : 2005 – 2016.
2. Nissen SE, Nicholls SJ, Sipahi I et al. Effect of very high‑intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial. JAMA 2006; 295 : 1556 – 1565.
3. Bots ML, Hoes AW, Koudstaal PJ et al. Common carotid intima ‑ media thickness and risk of stroke and myocardial infarction: the Rotterdam Study. Circulation 1997; 96 : 1432 – 1437.
4. Chambless LE, Folsom AR, Clegg LX et al. Carotid wall thickness is predictive of incident clinical stroke: the Atherosclerosis Risk in Communities (ARIC) study. Am J Epidemiol 2000; 151 : 478 – 487.
5. O'Rourke MF, Staessen JA, Vlachopoulos C et al. Clinical applications of arterial stiffness; definitions and reference values Am J Hypertens 2002; 15 : 426 – 444.
6. Munakata M, Sakuraba J, Tayama J et al. Higher brachial ‑ ankle pulse wave velocity is associated with more advanced carotid atherosclerosis in end‑stage renal disease. Hypertens Res 2005; 28 : 9 – 14.
7. Tomiyama H, Koji Y, Yambe M et al. Brachial ankle pulse wave velocity is a simple and independent predictor of prognosis in patients with acute coronary syndrome. Circ J 2005; 69 : 815 – 822.
8. Cecelja M, Chowienczyk P. Dissociation of aortic pulse wave velocity with risk factors for cardiovascular disease other than hypertension: a systematic review. Hypertension 2009; 54 : 1328 – 1336. doi: 10.1161/ HYPERTENSIONAHA.109.137653.
9. van Popele NM, Grobbee DE, Bots ML et al. Association between arterial stiffness and atherosclerosis: the Rotterdam Study. Stroke 2001; 32 : 454 – 460.
10. Yambe T, Yoshizawa M, Saijo Y et al. Brachio ‑ ankle pulse wave velocity and cardio ‑ ankle vascular index (CAVI). Biomed Pharmacother 2004; 58 (Suppl 1): S95 – S98.
11. Shirai K, Utino J, Otsuka K et al. A novel blood pressure‑independent arterial wall stiffness parameter; cardio ‑ ankle vascular index (CAVI). J Atheroscler Thromb 2006; 13 : 101 – 107.
12. Izuhara M, Shioji K, Kadota S et al. Relationship of cardio ‑ ankle vascular index (CAVI) to carotid and coronary arteriosclerosis. Circ J 2008; 72 : 1762 – 1767.
13. Miyoshi T, Doi M, Hirohata S et al. Cardio ‑ ankle vascular index is independently associated with the severity of coronary atherosclerosis and left ventricular function in patients with ischemic heart disease. J Atheroscler Thromb 2010; 17 : 249 – 258.
14. Yambe T, Meng X, Hou X et al. Cardio ‑ ankle vascular index (CAVI) for the monitoring of the atherosclerosis after heart transplantation. Biomed Pharmacother 2005; 59 (Suppl 1): S177 – S179.
15. Okura T, Watanabe S, Kurata M et al. Relationship between cardio ‑ ankle vascular index (CAVI) and carotid atherosclerosis in patients with essential hypertension. Hypertens Res 2007; 30 : 335 – 340.
16. Satoh N, Shimatsu A, Kato Y et al. Evaluation of the cardio ‑ ankle vascular index, a new indicator of arterial stiffness independent of blood pressure, in obesity and metabolic syndrome. Hypertens Res 2008; 31 : 1921 – 1930. doi: 10.1291/ hypres.31.1921.
17. Shirai K, Utino J, Saiki A et al. Evaluation of arteriosclerotic vascular disease with a new noble stiffness indicator, cardio ‑ ankle vascular index (CAVI). J Clin Exp Cardiolog 2012; S1 : 004. doi:10.4172/ 2155 - 9880.S1 - 004. [online] Available from: http:/ / omicsonline.org/ 2155 - 9880/ 2155 - 9880 - S1 - 004.php?aid=8080.
18. Shirai K, Hiruta N, Song M et al. Cardio ‑ ankle vascular index (CAVI) as a novel indicator of arterial stiffness: theory, evidence and perspectives. J Atheroscler Thromb 2011; 18 : 924 – 938.
19. Kubozono T, Miyata M, Ueyama K et al. Clinical significance and reproducibility of new arterial distensibility index. Circ J 2007; 71 : 89 – 94.
20. Takaki A, Ogawa H, Wakeyama T et al. Cardio ‑ ankle vascular index is superior to brachial ‑ ankle pulse wave velocity as an index of arterial stiffness. Hypertens Res 2008; 31 : 1347 – 1355. doi: 10.1291/ hypres.31.1347.
21. Ibata J, Sasaki H, Kakimoto T et al. Cardio ‑ ankle vascular index measures arterial wall stiffness independent of blood pressure. Diabetes Res Clin Pract 2008; 80 : 265 – 270. doi: 10.1016/ j.diabres.2007.12.016.
22. Shirai K, Song M, Suzuki J et al. Contradictory effects of beta1 – and alpha1 – aderenergic receptor blockers on cardio ‑ ankle vascular stiffness index (CAVI) – CAVI independent of blood pressure. J Atheroscler Thromb 2011; 18 : 49 – 55.
23. Namekata T, Suzuki K, Ishizuka N et al. Establishing baseline criteria of cardio ‑ ankle vascular index as a new indicator of arteriosclerosis: a cross ‑ sectional study. BMC Cardiovasc Disord 2011; 11 : 51. doi: 10.1186/ 1471 ‑ 2261 ‑ 11 ‑ 51.
24. Fukuda ‑ Denshi Company, LTD, Tokyo, Japan. [online] Available from: http:/ / www.fukuda.co.jp/ english/ products/ special_features/ vasera/ cavi.html.
25. Frank OD. Die theorie de pulswellen. Z Biol 1926; 85 : 91 – 130.
26. Parati G, Esler M. The human sympathetic nervous system: its relevance in hypertension and heart failure. Eur Heart J 2012; 33 : 1058 – 1066. doi: 10.1093/ eurheartj/ ehs041.
27. Matsuda Y, Kawate H, Matsuzaki C et al. Reduced arterial stiffness in patients with acromegaly: non‑invasive assessment by the cardio ‑ ankle vascular index (CAVI). Endocr J 2013; 60 : 29 – 36.
28. Wu HT, Hsu PC, Liu AB et al. Six ‑ channel ECG‑based pulse wave velocity for assessing whole ‑ body arterial stiffness. Blood Press 2012; 21 : 167 – 176. doi: 10.3109/ 08037051.2012.681853.
29. Huck CJ, Bronas UG, Williamson EB et al. Noninvasive measurements of arterial stiffness: repeatability and interrelationships with endothelial function and arterial morphology measures. Vasc Health Risk Manag 2007; 3 : 343 – 349.
30. Hayashi S. Significance of plasma D‑dimer in relation to the severity of atherosclerosis among patients evaluated by non‑invasive indices of cardio ‑ ankle vascular index and carotid intima ‑ media thickness. Int J Hematol 2010; 92 : 76 – 82. doi: 10.1007/ s12185 ‑ 010 ‑ 0622 ‑ 9.
31. Horinaka S, Yabe A, Yagi H et al. Cardio ‑ ankle vascular index could reflect plaque burden in the coronary artery. Angiology 2011; 62 : 401 – 408. doi: 10.1177/ 0003319710395561.
32. Nakamura K, Tomaru T, Yamamura S et al. Cardio ‑ ankle vascular index is a candidate predictor of coronary atherosclerosis. Circ J 2008; 72 : 598 – 604.
33. Park HE, Choi SY, Kim MK et al. Cardio ‑ ankle vascular index reflects coronary atherosclerosis in patients with abnormal glucose metabolism: assessment with 256 slice multi‑detector computed tomography. J Cardiol 2012; 60 : 372 – 376. doi: 10.1016/ j.jjcc.2012.07.005.
34. Korkmaz L, Adar A, Korkmaz AA et al. Atherosclerosis burden and coronary artery lesion complexity in acute coronary syndrome patients. Cardiol J 2012; 19 : 295 – 300.
35. Shimoyama T, Iguchi Y, Kimura K et al. Stroke patients with cerebral microbleeds on MRI scans have arteriolosclerosis as well as systemic atherosclerosis. Hypertens Res 2012; 35 : 975 – 979. doi: 10.1038/ hr.2012.84.
36. Saji N, Kimura K, Shimizu H et al. Silent brain infarct is independently associated with arterial stiffness indicated by cardio ‑ ankle vascular index (CAVI). Hypertens Res 2012; 35 : 756 – 760. doi: 10.1038/ hr.2012.20.
37. Choi SY, Park HE, Seo H et al. Arterial stiffness using cardio ‑ ankle vascular index reflects cerebral small vessel disease in healthy young and middle aged subjects. J Atheroscler Thromb 2013; 20 : 178 – 185.
38. Takatori K, Matsumoto D, Okada Y et al. Effect of intensive rehabilitation on physical function and arterial function in community ‑ dwelling chronic stroke survivors. Top Stroke Rehabil 2012; 19 : 377 – 383. doi: 10.1310/ tsr1905 ‑ 377.
39. Masugata H, Senda S, Murao K et al. Association between Urinary 8 – hydroxydeoxyguanosine, an Indicator of oxidative stress, and the cardio ‑ ankle vascular index in hypertensive patients. J Atheroscler Thromb 2012; 19 : 747 – 755.
40. Kotani K, Yamada S, Yamada T et al. Oxidized lipoprotein(a) and cardio ‑ ankle vascular index (CAVI) in hypertensive subjects. Heart Vessels 2013; 28 : 461 – 466. doi: 10.1007/ s00380 ‑ 012 ‑ 0265 ‑ 2.
41. Mizuguchi Y, Oishi Y, Tanaka H et al. Arterial stiffness is associated with left ventricular diastolic function in patients with cardiovascular risk factors: early detection with the use of cardio ‑ ankle vascular index and ultrasonic strain imaging. J Card Fail 2007; 13 : 744 – 751.
42. Sakane K, Miyoshi T, Doi M et al. Association of new arterial stiffness parameter, the cardio ‑ ankle vascular index, with left ventricular diastolic function. J Atheroscler Thromb 2008; 15 : 261 – 268.
43. Yoshida A, Sugiyama T, Sagawa N. Assessment of the cardioankle vascular index in pregnant women complicated with hypertensive disorders. ISRN Obstet Gynecol 2011; 2011 : 1 – 5. doi: 10.5402/ 2011/ 919816.
44. Ishimitsu T, Numabe A, Masuda T et al. Angiotensin‑II receptor antagonist combined with calcium channel blocker or diuretic for essential hypertension. Hypertens Res 2009; 32 : 962 – 968. doi: 10.1038/ hr.2009.133.
45. Kinouchi K, Ichihara A, Bokuda K et al. Differential effects in cardiovascular markers between high‑dose angiotensin II receptor blocker monotherapy and combination therapy of ARB with calcium channel blocker in hypertension (DEAR Trial). Int J Hypertens 2011; 2011 : 284823. doi: 10.4061/ 2011/ 284823.
46. Xu Y, Yan H, Yao J et al. Cardio ‑ ankle vascular index evaluations revealed that co ‑ treatment of ARB anti‑hypertension medication with traditional Chinese medicine improved arterial functionality. J Cardiovasc Pharmacol 2013; 61 : 355 – 360. doi: 10.1097/ FJC.0b013e31827afddf.
47. Kim ES, Moon SD, Kim HS et al. Diabetic peripheral neuropathy is associated with increased arterial stiffness without changes in carotid intima ‑ media thickness in type 2 diabetes. Diabetes Care 2011; 34 : 1403 – 1405. doi: 10.2337/ dc10 ‑ 2222.
48. Kim KJ, Lee BW, Kim HM et al. Associations between cardio ‑ ankle vascular index and microvascular complications in type 2 diabetes mellitus patients. J Atheroscler Thromb 2011; 18 : 328 – 336.
49. Wakabayashi I, Masuda H. Association of acute ‑ phase reactants with arterial stiffness in patients with type 2 diabetes mellitus. Clin Chim Acta 2006; 365 : 230 – 235.
50. Miyashita Y, Endo K, Saiki A et al. Effect of ezetimibe monotherapy on lipid metabolism and arterial stiffness assessed by cardio ‑ ankle vascular index in type 2 diabetic patients. J Atheroscler Thromb 2010; 17 : 1070 – 1076.
51. Takaki A, Ogawa H, Wakeyama T et al. Cardioankle vascular index is a new noninvasive parameter of arterial stiffness. Circ J 2007; 71 : 1710 – 1714.
52. Soška V, Dobšák P, Dušek L et al. Cardio ‑ ankle vascular index in heterozygous familial hypercholesterolemia. J Atheroscler Thromb 2012; 19 : 453 – 461.
53. Miyashita Y, Endo K, Saiki A et al. Effects of pitavastatin, a 3 – hydroxy ‑ 3 – methylglutaryl coenzyme a reductase inhibitor, on cardio ‑ ankle vascular index in type 2 diabetic patients. J Atheroscler Tromb 2009; 16 : 539 – 545.
54. Liu H, Zhang X, Feng X et al. Effects of metabolic syndrome on cardio ‑ ankle vascular index in middle ‑ aged and elderly Chinese. Metab Syndr Relat Disord 2011; 9 : 105 – 110. doi: 10.1089/ met.2010.0019.
55. Usui T, Tochiya M, Sasaki Y et al. Effects of natural S ‑ equol supplements on overweight or obesity and metabolic syndrome in the Japanese, based on sex and equol status. Clin Endocrinol 2013; 78 : 365 – 372. doi: 10.1111/ j.1365 ‑ 2265.2012.04400.x.
56. Kasai T, Inoue K, Kumagai T et al. Plasma pentraxin 3 and arterial stiffness in men with obstructive sleep apnea. Am J Hypertens 2011; 24 : 401 – 407. doi: 10.1038/ ajh.2010.248.
57. Kumagai T, Kasai T, Kato M et al. Establishment of the cardio ‑ ankle vascular index in patients with obstructive sleep apnea. Chest 2009; 136 : 779 – 786.
58. Yoshihisa A, Suzuki S, Yamaki T et al. Impact of adaptive servo ‑ ventilation on cardiovascular function and prognosis in heart failure patients with preserved left ventricular ejection fraction and sleep ‑ disordered breathing. Eur J Heart Fail 2013; 15 : 543 – 550. doi: 10.1093/ eurjhf/ hfs197.
59. Takenaka T, Hoshi H, Kato N et al. Cardio ‑ ankle vascular index to screen cardiovascular diseases in patients with end‑stage renal diseases. J Atheroscler Thromb 2008; 15 : 339 – 344.
60. Kimura H, Takeda K, Tsuruya K et al. Left ventricular mass index is an independent determinant of diastolic dysfunction in patients on chronic hemodialysis: a tissue Doppler imaging study. Nephron Clin Pract 2011; 117: c67 – c73. doi: 10.1159/ 000319649.
61. Sato H, Miida T, Wada Y et al. Atherosclerosis is accelerated in patients with long‑term well‑controlled systemic lupus erythematosus (SLE). Clin Chim Acta 2007; 385 : 35 – 42.
62. Kume K, Amano K, Yamada S et al. Tocilizumab monotherapy reduces arterial stiffness as effectively as etanercept or adalimumab monotherapy in rheumatoid arthritis: an open ‑ label randomized controlled trial. J Rheumatol 2011; 38 : 2169 – 2171. doi: 10.3899/ jrheum.110340.
63. Noike H, Nakamura K, Sugiyama Y et al. Changes in cardio ‑ ankle vascular index in smoking cessation. J Atheroscler Thromb 2010; 17 : 517 – 525.
64. Kubozono T, Miyata M, Ueyama K et al. Acute and chronic effects of smoking on arterial stiffness. Circ J 2011; 75 : 698 – 702.
65. Shiba T, Takahashi M, Hori Y et al. Optic nerve head circulation determined by pulse wave analysis is significantly correlated with cardio ankle vascular index, left ventricular diastolic function, and age. J Atheroscler Thromb 2012; 19 : 999 – 1005.
66. Kadota K, Takamura N, Aoyagi K et al. Availability of cardio ‑ ankle vascular index (CAVI) as a screening tool for atherosclerosis. Circ J 2008; 72 : 304 – 308.
67. Cecelja M, Chowienczyk P. Role of arterial stiffness in cardiovascular disease. J R Soc Med Cardiovasc Dis 2012; 1 : 11. doi: 10.1258/ cvd.2012.012016.
68. Avolio AP, Chen SG, Wang RP et al. Effects of aging on changing arterial compliance and left ventricular load in a northern Chinese urban community. Circulation 1983; 68 : 50 – 58.
69. Mitchell GF, Parise H, Benjamin EJ et al. Changes in arterial stiffness and wave reflection with advancing age in healthy men and women: the Framingham Heart Study. Hypertension 2004; 43 : 1239 – 1245.
70. Yasmin, McEniery CM, O’Shaughnessy KM et al. Variation in the human matrix metalloproteinase ‑ 9 gene is associated with arterial stiffness in healthy individuals. Arterioscler Thromb Vasc Biol 2006; 26 : 1799 – 1805.
71. O’Rourke MF, Hashimoto J. Mechanical factors in arterial aging: a clinical perspective. J Am Coll Cardiol 2007; 50 : 1 – 13.
72. Kim B, Takada K, Oka S et al. Influence of blood pressure on cardio ‑ ankle vascular index (CAVI) examined based on percentage change during general anesthesia. Hypertens Res 2011; 34 : 779 – 783. doi: 10.1038/ hr.2011.31.
73. Shirai K. Analysis of vascular function using the cardio ‑ ankle vascular index (CAVI). Hypertens Res 2011; 34 : 684 – 685. doi: 10.1038/ hr.2011.40.
74. Kawano H, Iemitsu M, Gando Y et al. Habitual rowing exercise is associated with high physical fitness without affecting arterial stiffness in older men. J Sports Sci 2012; 30 : 241 – 246. doi: 10.1080/ 02640414.2011.635311.
75. Takenaka T, Hoshi H, Kato N et al. Cardio ‑ ankle vascular index to screen cardiovascular diseases in patients with end‑stage renal diseases. J Atheroscler Thromb 2008; 15 : 339 – 344.
76. Takahashi M, Shiba T, Hirano K et al. Acute decrease of cardio ‑ ankle vascular index with the administration of beraprost sodium. J Atheroscler Thromb 2012; 19 : 479 – 484.
77. Liu H, Saijo Y, Zhang X et al. Comparative analysis of cardio ‑ ankle vascular index between Japanese and Russians. In: Esashi M, Ishii K, Ohuchi N et al (eds). Future medical engineering based on bionanotechnology: Proceedings of the Final Symposium of the Tohoku University 21st Century Center of Excellence Program. London: Imperial College Press 2006 : 411 – 418.
78. Uurtuya S, Taniguchi N, Kotani K et al. Comparative study of the cardio ‑ ankle vascular index and ankle ‑ brachial index between young Japanese and Mongolian subjects. Hypertens Res 2009; 32 : 140 – 144. doi: 10.1038/ hr.2008.28.
79. Uurtuya S, Kotani K, Taniguchi N, et al. Comparative study of atherosclerotic parameters in Mongolian and Japanese patients with hypertension and diabetes mellitus. J Atheroscler Thromb 2010; 17 : 181 – 188.
80. Hirasada K, Niimura H, Kubozono T et al. Values of cardio ‑ ankle vascular index (CAVI) between Amami islands and Kagoshima mainland among health checkup examinees. J Atheroscler Thromb 2012; 19 : 69 – 80.
81. Martí R, Parramon D, García ‑ Ortiz L et al. Improving interMediAte risk management. MARK study. BMC Cardiovasc Disord 2011; 11 : 61 – 66. doi: 10.1186/ 1471 ‑ 2261 ‑ 11 ‑ 61.
82. Nagayama D, Saiki A, Endo K et al. Improvement of cardio ‑ ankle vascular index by glimepiride in type 2 diabetic patients. Int J Clin Pract 2010; 64 : 1796 – 1801. doi: 10.1111/ j.1742 ‑ 1241.2010.02399.x.
83. Miyoshi T, Doi M, Hirohata S et al. Olmesartan reduces arterial stiffness and serum adipocyte fatty acid‑binding protein in hypertensive patients. Heart Vessels 2011; 26 : 408 – 413. doi: 10.1007/ s00380 ‑ 010 ‑ 0060 ‑ x.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2014 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Erektilní dysfunkce
- Endoteliální dysfunkce, erektilní dysfunkce a kardiovaskulární riziko
- Doporučení pro sexuální aktivitu nemocných s kardiovaskulárním onemocněním a jejich partnery – AHA, ESC GUIDELINES 2013
- Klinický význam parametru CAVI (Cardio‑ Ankle Vascular Index) v prevenci, diagnostice a terapii
- Farmakoterapie erektilní dysfunkce – kde jsme a kam směřujeme
- Terapie erektilní dysfunkce dle Guidelines Evropské urologické asociace
- Urologické příčiny erektilní dysfunkce
- Psychogenní erektilní dysfunkce
- Mužské sexuální dysfunkce jako párový problém
- AUTORSKÁ SOUTĚŽ ČASOPISU KARDIOLOGICKÁ REVUE – INTERNÍ MEDICÍNA
- Angiologie
- Povrchová žilní trombóza – epidemiologie, diagnostika, léčba
- Chronické žilní onemocnění dolních končetin – diagnostika a konzervativní léčba
- Chronická žilní insuficience – invazivní terapie
- Syndrom pánevní kongesce
- Možnosti léčby hluboké žilní trombózy v roce 2014
- Sulodexid u angiologických pacientů
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Syndrom pánevní kongesce
- Povrchová žilní trombóza – epidemiologie, diagnostika, léčba
- Chronické žilní onemocnění dolních končetin – diagnostika a konzervativní léčba
- Psychogenní erektilní dysfunkce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




