-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
HOT lines na sjezdu České kardiologické společnosti
Autoři: J. Špinar 1; P. Janský 2
Působiště autorů: Interní kardiologická klinika LF MU a FN Brno 1; Klinika kardiovaskulární chirurgie 2. LF UK a FN v Motole, Praha 2
Vyšlo v časopise: Kardiol Rev Int Med 2014, 16(3): 196-201
Kategorie: Kardiologická revue
Ve dnech 4. – 7. května 2014 probíhal na brněnském výstavišti tradiční sjezd České kardiologické společnosti. Pracovní skupina Farmakoterapie připravila (jako každý rok) atraktivní blok HOT lines, ve kterém byly představeny nejvýznamnější farmakologické studie prezentované za posledních 12 měsíců. Bloku předsedali MU Dr. Petr Janský CSc. (předseda PS Farmakoterapie) a prof. MU Dr. Jindřich Špinar, CSc., FESC.
Profesor Špinar prezentoval v sekci HOT lines klinickou studii ENGAGE (Edoxaban versus Warfarin in Patiens with Atrial Fibrillation) s edoxabanem u nemocných s fibrilací síní. Studie byla poprvé přednesena na americké kardiologické konferenci AHA (American Heart Association) v Dallasu v listopadu 2013 R. Giuglianem a výsledky studie ENGAGE byly současně publikovány v prestižním časopise New England Journal of Medicine. Studie prokázala noninferioritu edoxabanu vůči warfarinu na ischemické CMP a superioritu na hemoragické CMP u nemocných s fibrilací síní.
Edoxaban je přímý orální inhibitor faktoru Xa a má prokázaný antikoagulační i antiagregační účinek (v Japonsku je již několik let užíván v prevenci tromboembolické nemoci (TEN) po ortopedických operacích). Doposud nebyly známy výsledky dlouhodobé mortalitní studie u pacientů s fibrilací síní. Studie ENGAGE randomizovala do dvojitě slepé fáze 21 105 pacientů z toho 1 173 v České republice, národním koordinátorem byl prof. Špinar (největším centrem na světě se 160 pacienty byla Interní kardiologická klinika LF MU a FN Brno s koordinátorkou studie doc. Lábrovou).
Roční výskyt primárního cíle byl 1,50 % na warfarinu, 1,18 % na vysoké dávce edoxabanu (p < 0,001 pro noninferioritu) a 1,61 % na nízké dávce edoxabanu (p = 0,005 pro noninferioritu) (obr. 1). Roční výskyt krvácení na warfarinu byl 3,43 %, na vysoké dávce edoxabanu 2,75 % (p < 0,001) a na nízké dávce 1,61 % (p < 0,001). Byl výrazně snížen výskyt smrtelných krvácivých komplikací, na druhé straně byl pozorován zvýšený výskyt slizničního krvácení, především gastrointestinálního (obr. 2).
Obr. 1. Výsledky studie ENGAGE – primární cíl. 
Obr. 2. Výsledky studie ENGAGE – bezpečnostní cíle. 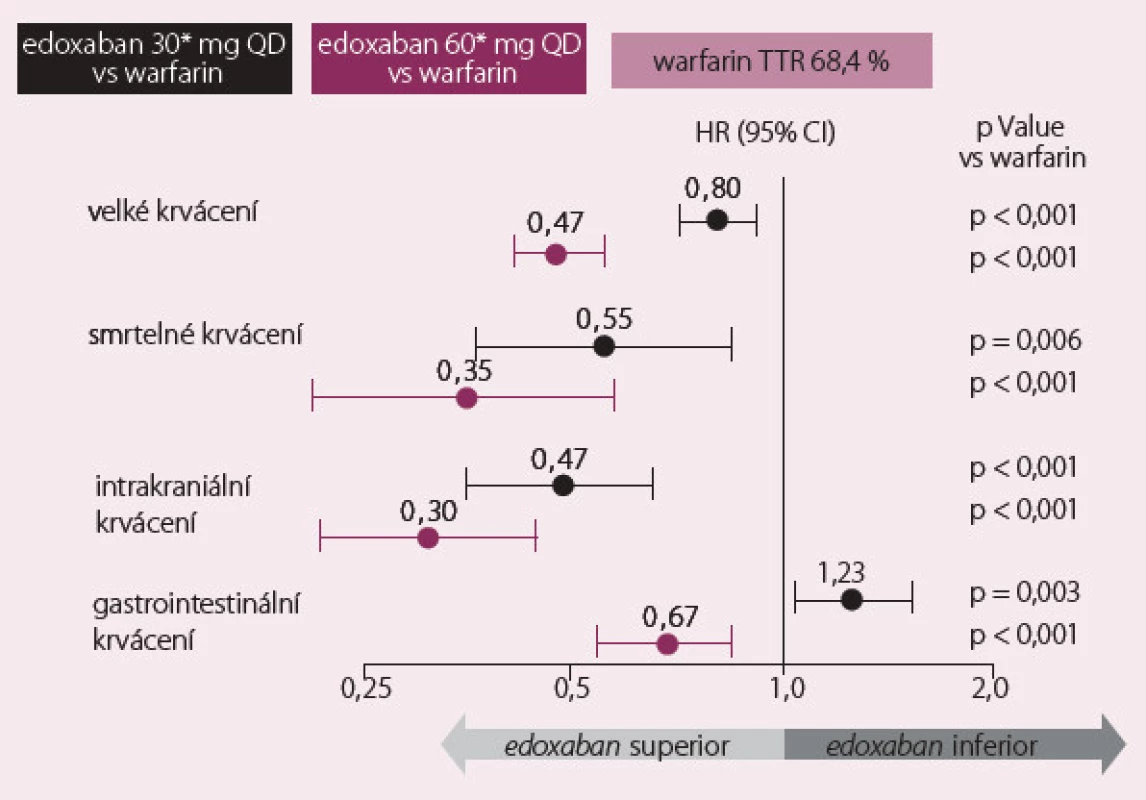
Hlavní silou studie ENGAGE AF ‑ TIMI 48 je velmi rozsáhlý vzorek nemocných, dlouhodobé sledování s minimem ztracených pacientů a velmi vysoký počet nemocných na warfarinu v terapeutickém okně (68,4 %). Nedostatkem je celkově nízký výskyt primárního cíle i u nemocných léčených warfarinem. Celkově je třeba podtrhnout, že obě dávky edoxabanu byly noninferiorní na prevenci CMP a systémové embolie s výrazně nižším výskytem krvácení a úmrtím z kardiovaskulárních příčin. Studie ENGAGE tak doplnila zkušenosti s novými antikoagulancii, které již jsou na českém trhu registrovány.
Profesor Vítovec referoval o studii TOPCAT (Spironolactone for Heart Failure with Preserved Ejection Fraction). Tato randomizovaná, dvojitě slepá studie zahrnovala 3 445 pacientů se symptomatickým srdečním selháním a zachovalou ejekční frakcí nad 45 %, kteří dostali buď spironolakton (15 – 45 mg denně) nebo placebo. Primární cíl byl složený: kardiovaskulární úmrtí, úspěšně resuscitovaná srdeční zástava či hospitalizace z důvodu zhoršeného srdečního selhání. Doba sledování byla 3,3 roku a primární cíl se vyskytl u 320 z 1 722 nemocných na spironolaktonu (18,6 %) a 351 z 1 723 nemocných na placebu (20,4 %) (HR, 0,89; 95% CI 0,77 – 1,04; p = 0,14) (graf 1). Co se týče pouhých hospitalizací pro zhoršení srdečního selhání byl výskyt signifikantně nižší ve skupině se spironolaktonem (206 pts (12,0 %) vs 245 pts (14,2 %); HR 0,83; 95% CI, 0,69 – 0,99; p = 0,04). Z vedlejších účinků byla pozorována významně vyšší hyperkalemie po spironolaktonu, jiné parametry (kreatinin, nutnost dialýzy) nebyly pozorovány. U nemocných se srdečním selháním a zachovalou ejekční frakcí nevedla léčba spironolaktonem signifikantně ke snížení složeného primárního cíle (KV úmrtí, resuscitace pro srdeční zástavu, hospitalizace pro zhoršené srdeční selhání), ale byl pozorován statisticky významný pokles samotných hospitalizací pro zhoršené srdeční selhání.
Graf 1. Výsledky studie TOPCAT. 
Docent Malý prezentoval výsledky studie ACCOAST (A comparison of prasugrel at the time of PCI or as pretreatment at the time of diagnosis in patients with non‑ST elevation myocardial infarction), která se zabývala otázkou předléčení pacientů s akutním koronárním syndromem bez elevací ST úseku plánovaných k invazivnímu řešení prasugrelem – novým protidestičkovým lékem ze skupiny thienopyridinů. Výsledky byly prezentovány prof. Montalescotem na Evropském kardiologickém sjezdu v roce 2013 v Amsterodamu a publikovány byly ve stejném roce v časopise New England Journal of Medicine.
Současné Doporučené postupy pro léčbu pacientů s akutním koronárním syndromem (AKS) při nepřítomnosti elevací úseku ST (NSTEMI), u kterých je plánováno invazivní vyšetření, doporučují předléčení clopidogrelem. Ve studii TRITON ‑ TIMI 38 srovnávající účinnost prasugrelu a clopidogrelu u pacientů s AKS léčených intervenčně prasugrel snižoval významně výskyt ischemických příhod. V této studii byl prasugrel podáván až po provedení koronární angiografie, tedy se znalostí koronární anatomie. Studie ACCOAST studovala předpoklad, že předléčení prasugrelem u všech pacientů s NSTEMI bude účinnější oproti podání prasugrelu selektivně až v souvislosti s provedením perkutánní koronární intervence (PCI) po provedené diagnostické koronarografii.
U pacientů byl při stanovení diagnózy NSTEMI podán buď prasugrel v dávce 30 mg, nebo placebo. Když bylo (po koronární angiografii) plánováno provedení PCI, bylo v předléčené větvi podáno dalších 30 mg a v placebové větvi 60 mg prasugrelu. Pacienti byli léčeni kyselinou acetylsalicylovou (98 %), nefrakcionovaným heparinem (65,5 %), bivalirudinem (0,8 %), fondaparinuxem (4 %) a statiny (89,5 %).
Celkem bylo randomizováno 4 033 pacientů: 2 037 do větve předléčené prasugrelem a 1 996 do placebové větve. Medián mezi první nasycovací dávkou a angiografií byl 4,2 hod. PCI bylo provedeno u 68,7 % a aorto koronární bypass (CABG) u 6,2 % pacientů; ostatní pacienti byli léčeni konzervativně.
Studie byla ukončena předčasně, neboť se neprokázala vyšší účinnost předléčení. Primární cílový ukazatel (úmrtí z kardiovaskulárních příčin, infarkt myokardu, cévní mozková příhoda, nutnost urgentní revaskularizace a vynucené podání glykoproteinů IIbIIIa) byl během prvních sedmi dnů od randomizace stejný mezi oběma větvemi (10 vs 9,8 %, HR 1,02, 95% CI 0,84 – 1,25; p = 0,81) (graf 2). Jednotlivé složky cílového ukazatele zahrnující úmrtí z kardiovaskulárních příčin (0,3 vs 0,5 %), infarktu myokardu (5,8 vs 5,5 %) a cévní mozkové příhody (0,4 vs 0,5 %) se též nelišily. Primární cílový ukazatel se nelišil ani během 30denního sledování (10,8 vs 10,8; p = 0,98). Výskyt trombózy stentu byl v obou skupinách nízký (0,1 vs 0,4; p = 0,25).
Graf 2. Výsledky studie ACCOAST – primární cíl. 
Primární bezpečnostní ukazatel – krvácení u pacientů v souvislosti s provedeným CABG – tak byl i bez této souvislosti významně zvýšen v předléčené skupině, a to jak po sedmi dnech (2,6 vs 1,4 %; p = 0,006), tak i po 30 dnech (2,8 vs 1,5 %; p = 0,002) sledování (graf 3). Zvýšený výskyt velkého krvácení byl dán jeho zvýšením hlavně ve skupině bez souvislosti s provedeným CABG (1,3 vs 0,5 %; p = 0,003). Stejně tak bylo významně zvýšeno život ohrožující krvácení (0,8 vs 0,2 %; p = 0,002).
Graf 3. Výsledky studie ACCOAST – krvácení. 
Výsledky studie ACCOAST tedy neprokázaly, že by předléčení pacientů s NSTEMI plánovaných k invazivnímu řešení 30 mg prasugrelu vedlo k vyšší účinnosti ve smyslu snížení ischemických příhod a naopak bylo spojeno s vyšším výskytem krvácení, včetně život ohrožujícího. Doporučení pro léčbu těchto pacientů prasugrelem tedy zůstává stejné jako ve studii TRITON TIMI 38 – sytící dávku 60 mg podat až v souvislosti s provedením PCI. Výsledky jsou konkluzivní i se studií TRILOGY ‑ ACS, kde prasugrel u pacientů s NSTEMI léčených konzervativně oproti clopidogrelu nevedl ke snížení ischemických příhod a zvyšoval krvácivé komplikace. Prasugrel je tedy indikován k léčbě NSTEMI pouze u pacientů v návaznosti na provedení PCI.
Doktor Janský referoval o výsledcích studie POISE ‑ 2. Tato studie byla prezentována na sjezdu American College of Cardiology ve Washingtonu v březnu tohoto roku a zároveň byla publikována v časopise New England Journal of Medicine. Cílem studie POISE ‑ 2 bylo posoudit účinnost a bezpečnost perioperativního podávání kyseliny acetylsalicylové a klonidinu u pacientů, kteří podstupují nekardiochirurgický operační výkon. Do studie bylo zařazeno 10 010 pacientů s průměrným věkem 69 let, 47 % z nich byly ženy, 23 % mělo ischemickou chorobu srdeční, 38 % diabetes mellitus. Aspirin byl podáván v dávce 200 mg těsně před operací. U pacientů, kteří dosud aspirin neužívali, bylo v léčbě dávkou 100 mg denně pokračováno 30 dní po operaci. Pacientům, kteří aspirin užívali dlouhodobě již před plánovanou operací, byla léčba vysazena týden před výkonem. Studijní léčba pak pokračovala týden po operaci. Primární ukazatel účinnosti (výskyt úmrtí a nefatálních infarktů myokardu do 30 dnů po operaci) se vyskytl u 7 % pacientů na aspirinu a u 7,1 % v placebové skupině (p = 0,92) (graf 4). Léčba aspirinem navíc vedla k významně vyššímu výskytu závažných krvácivých komplikací – 4,6 vs 3,8 % (p = 0,04). Podávání klonidinu rovněž nepřineslo příznivý výsledek. Výskyt primárního ukazatele účinnosti se nelišil ve srovnání s placebem (7,3 vs 6,8 %; p = 0,29). Léčba klonidenem však vedla k významně častějšímu výskytu klinicky významné hypotenze (47,6 vs 37,1 %; p < 0,001), klinicky významné bradykardie (12,0 vs 8,1 %; p < 0,001) a k vyššímu výskytu nefatálních srdečních zástav (0,3 vs 0,1 %; p = 0,02). Nebyla zjištěna žádná interakce mezi léčbou aspirinem a klonidinem. Výsledky studie byly konzistentní i při analýze podskupin. Vysvětlením negativního výsledku studie POISE ‑ 2 je pravděpodobně fakt, že závažná krvácení po podávání aspirinu i klinicky významné hypotenze při léčbě klonidinem byly statisticky významně spojeny se zvýšením rizika perioperačních infarktů. Studie POISE ‑ 2 přesvědčivě prokázala, že paušální podávání aspirinu nebo klonidinu u nekardiochirurgických operací není přínosné.
Graf 4. Výsledky studie POISE 2 – primární cíl. 
Profesorka Špinarová prezentovala studii SAVOR (Saxagliptin and Cardiovascular Outcomes in Patients with Type 2 Diabetes Mellitus). Léčba diabetes mellitus 2. typu je v současnosti účinná, ale bohužel ještě není ideální. Jistému ideálu se již blíží terapie založená na inkretinech, která je významným kvalitativním pokrokem. První ukončenou mortalitní studií s inhibitory dipeptidyl peptidázy (DPP ‑ 4) je studie SAVOR prezentovaná v Amsterdamu na Evropském kardiologickém kongresu 2013.
Studie SAVOR randomizovala 16 492 nemocných s diabetes mellitus 2. typu a vysokým rizikem kardiovaskulárních příhod na léčbu saxagliptinem či placebem. Průměrná doba sledování byla 2,1 let.
Primární cíl (kardiovaskulární úmrtí, nefatální infarkt myokardu a nefatální CMP) se vyskytl u 7,3 % (613) nemocných léčených saxagliptinem a u 7,2 % (609) nemocných léčených placebem (HR 1,00; p < 0,001 pro noninferioritu) (graf 5). Hlavní sekundární cíl (kardiovaskulární úmrtí, infarkt myokardu, cévní mozková příhoda, hospitalizace pro srdeční selhání či anginu pectoris a revaskularizace myokardu) byla u 12,8 % (1 059) nemocných léčených saxagliptinem a u 12,4 % (1 034) nemocných léčených placebem.
Graf 5. Výsledky studie SAVOR – primární cíl. 
Závěrem bylo konstatováno, že DPP ‑ 4 inhibitor saxagliptin nezvýšil výskyt ischemických kardiovaskulárních příhod, měl ale trend ke zvýšení hospitalizací pro srdeční selhání. Nezvyšoval výskyt pankreatitidy. Současně signifikantně zlepšoval kontrolu diabetes mellitus, což by mohlo být signálem pro budoucí zlepšení kardiovaskulárních cílů.
Žádná léčba diabetes mellitus 2. typu po infarktu myokardu doposud neprokázala jednoznačné snížení kardiovaskulárního rizika, které diabetes přináší. Velké naděje v tomto směru byly vkládány do modulátorů jaderných receptorů aktivovaných proliferátory peroxizomů (PPAR) působících zvýšení citlivosti k inzulinu, snížení glykemie a zlepšení lipidového profilu. Výsledky studií fáze 2 byly slibné. Cílem studie AleCardio (Effect of Aleglitazar on Cardiovascular Outcomes After Acute Coronary Syndrome in Patients With Type 2 Diabetes Mellitus), o které referoval dr. Janota, byl průkaz redukce kardiovaskulární morbidity a mortality aleglitazorem oproti placebu u diabetiků 2. typu po recentně prodělaném akutním koronárním syndromu. Aleglitazor je duální agonista PPAR‑alfa a gama. AleCardio byla dvojitě zaslepená placebem kontrolovaná studie 3. fáze. Mezi únorem 2010 a květnem 2012 do ní bylo zařazeno 7 226 nemocných z 26 zemí včetně ČR. Nemocní byli vedle standardní léčby randomizováni k léčbě 150 µg aleglitazoru nebo placeba. Sledování bylo plánováno na minimálně 2,5 roku nebo do docílení 950 primárních cílů. Primární cíle zahrnovaly úmrtí z kardiovaskulárních příčin, nefatální infarkty myokardu a cévní mozkové příhody. Studie byla zastavena předčasně v červenci 2013 pro zvýšený výskyt bezpečnostních cílů. V době zastavení byl průměrný follow‑up dva roky.
Výsledky studie byly předneseny 30. března 2014 na sjezdu American College of Cardiology ve Washingtonu. V době zastavení studie byl výskyt primárních cílů 9,5 % u pacientů léčených aleglitazorem a 10 % u placeba (HR = 0,96; 95% CI, 0,83 – 1,11) (graf 6). Signifikantně byla snížena potřeba hospitalizací po nestabilní anginu pectoris a neplánované revaskularizace. Mírně klesl počet infarktů. Při analýze ve třech měsících léčby byl signifikantně snížen glykovaný hemoglobin a potřeba trvalé inzulinoterapie. Došlo k signifikantnímu zvýšení HDL cholesterolu. Triglyceridy a apolipoprotein‑B klesly. Ve sledovaných parametrech nebyl patrný žádný rozdíl v podskupinách.
Graf 6. Výsledky studie AleCardio – primární cíl. 
Důvodem zastavení studie byl vzestup závažných nežádoucích příhod: srdečního selhání (3,4 vs 2,8 %; p = 0,14), renálního selhání (7,4 vs 2,7 %; p < 0,001) a gastrointestinálních krvácení (2,4 vs 1,7 %; p = 0,03). Patrný byl také častější výskyt zlomenin kostí, hypoglykemií a nevýznamný vzestup mortality. Častější byly otoky a vzestup váhy.
Neúspěch studie AleCardio byl další v řadě studií s duálními agonisty PPAR končících s nedostatečným primárním efektem a řadou nežádoucích účinků. AleCardio zřejmě znamená konec léčby agonisty PPAR (možná s výjimkou pioglitazonu, agonisty PPAR‑gama).
Sekci HOT lines zahajoval prof. Špinar studií ENGAGE s edoxabanem, která měla jasně pozitivní výsledek. Následovaly studie TOPCAT, ACCOAST, POISE ‑ 2, SAVOR a ALECARDIO s výsledkem neutrálním až negativním. Na závěr proto přišla opět studie s edoxabanem a s pozitivním výsledkem, tentokrát hluboká žilní trombóza, o které referoval doc. Chlumský.
Studie Hokusai – VTE sledovala účinnost a bezpečnost edoxabanu v léčbě akutní tromboembolické nemoci (TEN). Celkem bylo randomizováno 8 292 pacientů z 439 center ve 37 zemích, přibližně 60 % nemocných mělo trombózu dolní končetiny a 40 % plicní embolii. Všichni pacienti ve studii Hokusai – VTE byli léčeni enoxaparinem po dobu nejméně pěti dnů. Následně byli nemocní převedeni na léčbu edoxabanem 60 mg jednou denně nebo na warfarin. Antikoagulační léčba trvala 3 – 12 měsíců. Tři skupiny pacientů měly redukovanou dávku edoxabanu (30 mg jednou denně) – osoby s poruchou funkce ledvin, s hmotností pod 60 kg a nemocní léčení silnými inhibitory P ‑ glykoproteinu.
Výskyt recidivy symptomatické VTE byl u 3,2 % nemocných léčených edoxabanem oproti 3,5 % nemocných na warfarinu (HR 0,89; p < 0,001) (graf 7). Významně méně nemocných léčených edoxabanem po dobu sledování mělo velké nebo klinicky významné krvácení – 8,5 % ve srovnání s 10,3 % ( HR 0,81; p = 0,004) (graf 8). Velmi dobrá účinnost edoxabanu byla zjištěna v podskupině nemocných s plicní embolií a dysfunkcí pravé komory hodnocenou zvýšením NT ‑ pro – BNP. V této skupině mělo 3,3 % nemocných léčených edoxabanem a 6,2 % ve skupině warfarinu mělo recidivu TEN (HR 0,52). Nemocní se sníženou dávkou edoxabanu – zejména z důvodu renální insuficience – měli zachovanou účinnost s výrazně nižším rizikem krvácení, než bylo pozorováno ve skupině léčené warfarinem.
Graf 7. Výsledky studie HOKUSAI – VTE – recidiva tromboembolické nemoci. 
Graf 8. Výsledky studie HOKUSAI – VTE – krvácení. 
Celkově je možné shrnout, že léčba edoxabanem je u nemocných s TEN stejně účinná a zároveň bezpečnější než léčba warfarinem. Důležité je zjištění dobré účinnosti léčby u nemocných s plicní embolií a dysfunkcí pravé komory. Výsledky potvrzují nálezy studií s ostatními inhibitory faktoru X (rivaroxaban, apixaban) a ukazují na dobrou účinnost a bezpečnost celé této skupiny léků.
prof. MUDr. Jindřich Špinar, CSc., FESC
www.fnbrno.cz
jspinar@fnbrno.cz
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek Idiopatické střevní zánětyČlánek Chronická pankreatitidaČlánek Editorial – Interní medicínaČlánek Refluxní nemoc jícnu
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2014 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- prof. MUDr. Miloš Štejfa, DrSc., FESC (*28. 5. 1929)
- Léčba akutního srdečního selhání
- Pravidelné supraventrikulární tachykardie – diagnóza, léčba a zkušenosti vysokoobjemového kardiocentra
- Moderní trendy v léčbě dlouhodobé perzistující fibrilace síní
- Standardizace ošetřovatelské péče k dekanylaci sheathu na intervenčních pracovištích v České republice
- HOT lines na sjezdu České kardiologické společnosti
- AUTORSKÁ SOUTĚŽ ČASOPISU KARDIOLOGICKÁ REVUE – INTERNÍ MEDICÍNA
- Editorial – Interní medicína
- Perorální endoskopická myotomie (POEM) – nová endoskopická možnost léčby achalázie jícnu
- Refluxní nemoc jícnu
- Léčba inhibitory protonové pumpy
- Celiakie – současný pohled na etiopatogenezi, diagnostiku a terapii
- Dráždivý tračník – diagnostika a léčba
- Divertikulární choroba tlustého střeva – nové trendy v léčbě
- Screening kolorektálního karcinomu
- Idiopatické střevní záněty
- Chronická pankreatitida
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Divertikulární choroba tlustého střeva – nové trendy v léčbě
- Dráždivý tračník – diagnostika a léčba
- Chronická pankreatitida
- Léčba inhibitory protonové pumpy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



