-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Předpověď úspěšnosti a selhání endoskopické ventrikulocisternostomie III. komory
Prediction of Success and Failure of Endoscopic Third Ventriculostomy
At present, endoscopic third ventriculostomy (ETV) is regarded as the method of the first choice in the treatment of obstructive hydrocephalus. ETV is indicated in patients with obstruction in the ventricular system distally from the aqueduct; some authors had also used the method in patients with other types of hydrocephalus. The method is successful in about 2/3 of patients and its success depends on numerous factors. In our report, we attempt to summarize current knowledge on predicting success of ETV. We describe pre-, peri - and postoperative factors and their effect on the success of ETV.
Key words:
endoscopy – hydrocephalus – endoscopic third ventriculostomy – prognosis
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: T. Krejčí 1,2; M. Mrůzek 1; Z. Večeřa 1,2; O. Krejčí 1; M. Chlachula 1; R. Lipina 1,2
Působiště autorů: Neurochirurgická klinika LF OU a FN Ostrava 1; LF OU v Ostravě 2
Vyšlo v časopise: Cesk Slov Neurol N 2015; 78/111(4): 413-422
Kategorie: Přehledný referát
Souhrn
Endoskopická ventrikulocisternostomie III. komory (ETV) je v současnosti považována za metodu první volby v léčbě obstrukčního hydrocefalu. Je indikována v případě obstrukce v komorovém systému distálně od akveduktu, některými autory pak i u jiných typů hydrocefalu. Úspěšnost této metody se pohybuje v průměru kolem 2/ 3 operovaných pacientů a je závislá na celé řadě faktorů. V našem sdělení se snažíme shrnout současné poznatky zabývající se předpovědí úspěšnosti ETV. Popisujeme faktory před-, peri - a pooperační a jejich vliv na úspěšnost ETV.
Klíčová slova:
endoskopie – hydrocefalus – endoskopická ventrikulocisternostomie III. komory – prognózaÚvod
Endoskopická ventrikulocisternostomie (ETV) spočívá ve vytvoření komunikace mezi III. mozkovou komorou a interpedunkulární cisternou, je tedy indikována u obstrukčního hydrocefalu. Stomií eliminujeme překážku distálně od akveduktu až po výše zmíněnou cisternu. Původní koncept tradičního dělení hydrocefalu na obstrukční a komunikující bývá v poslední době napadán. Někteří autoři označují všechny typy hydrocefalu jako obstrukční, rozlišují jen místo obstrukce, ať už toku likvoru (komorový systém, cisterny) nebo v místě jeho absorpce [1,2]. Mechanizmus účinku ETV je tedy pravděpodobně složitější, což naznačuje i fakt, že je úspěšná také u určité skupiny pacientů bez zjevné obstrukce v komorovém systému [3,4]. Nejenže vytváří komunikaci komorového systému se subarachnoidálním prostorem, ale předpokládá se i zlepšení poddajnosti mozku (compliance) po úspěšné ETV. Po otevření komorového systému do bazálních cisteren dochází během systoly k zvýšení množství vyloučeného mozkomíšního moku z komor a tím k redukci pulzního tlaku a jeho efektu na mozkový parenchym. Po zlepšení poddajnosti mozku dochází ke zlepšení mozkového průtoku a perfuzního tlaku, čímž se snižuje rezistence k reabsorpci mozkomíšního moku [3,4].
Z časového hlediska lze selhání ETV rozdělit na časné a pozdní (tab. 1). Časným je myšleno selhání zpravidla v prvních týdnech až měsících, zejména však do tří měsíců po ETV [5 – 7]. Časné selhání je nejčastější. Někteří autoři uvádí, že má‑li selhání nastat, stane se tak zpravidla v 90 % v prvních dvou týdnech po ETV [7]. Příčina je především v přítomnosti poruchy resorpce mozkomíšního moku, ve špatném technickém provedení ETV, případně i v časném uzávěru stomie [5]. Pozdní selhání je vzácné, může však mít fatální důsledky, což potvrzuje i naše zkušenost [5,6,8]. Nastává zpravidla desítky měsíců po úspěšné ETV a důvodem je především spontánní uzávěr stomie gliální jizvou [5,8]. Ve srovnání se zkratovými operacemi je riziko selhání ETV v prvních třech měsících výrazně vyšší, v další době riziko selhání ETV progresivně klesá, kdežto riziko selhání zkratových výkonů se zvyšuje [9]. V následujícím textu se budeme snažit shrnout literaturu věnující se možnostem predikce selhání a úspěšnosti ETV. Z praktického hlediska dělíme faktory ovlivňující selhání ETV na před ‑ , peri ‑ a pooperační.
Tab. 1. Časové selhání ETV. 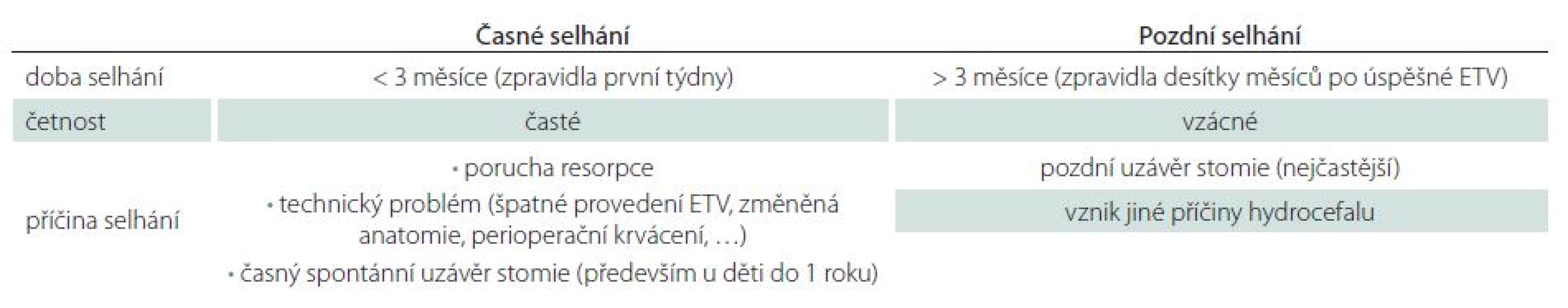
ETV – endoskopická ventrikulocisternostomie. Historie ETV
První neuroendoskopický výkon provedl v roce 1910 V. L’Espinasse z Chicaga. Pomocírigidního uretroskopu koaguloval choroidální plexus u dvou dětských pacientů v rámci léčby hydrocefalu, dle dostupných informací první pacient přežíval pět let po operačním výkonu, druhý z pacientů umírá bezprostředně po výkonu [10]. Za otce myšlenky obejít překážku při obstrukci mokovodu vytvořením komunikace mezi komorovým systémem a subarachnoidálním prostorem je považován Walter E. Dandy. V roce 1922 jako první provádí ventrikulocisternostomii vytvořením komunikace mezi chiazmatickou cisternou a III. komorou po perforaci laminy terminalis subfrontálním přístupem a posléze subtemporálním přístupem spojuje III. komoru s interpedunkulární cisternou [11]. Roku 1945 pak publikuje 50% úspěšnost této metody u 92 pacientů s hydrocefalem [12]. První, kdo provedl endoskopickou ventrikulocisternostomii, byl v roce 1923 William J. Mixter [10,11]. Za použití uretroskopu perforoval spodinu III. komory do interpedunkulární cisterny. V další době byla technika ETV opuštěna z důvodů nekvalitního zobrazení původních endoskopů a taktéž pro příchod zkratových operací v 50. letech 20. století [11]. K renezanci ETV dochází začátkem 90. let 20. století díky zdokonalení optických systémů a také v důsledku narůstajících obav z komplikací spojených s implantací zkratových operací [11]. Koncem 90. let 20. století začíná být tato technika všeobecně uznávána díky publikaci prvních výsledků větších souborech pacientů (G. Cinalli, N. J. Hopf, C. Teo, J. A. Grotenhuis). Na přelomu tisíciletí začíná být tento typ výkonu prováděn i v České republice. Prvními průkopníky v této oblasti jsou tato pracoviště: Neurochirurgická klinika LF MU a FN u sv. Anny v Brně, Neurochirurgická klinika LF UK a FN Hradec Králové a Neurochirurgická klinika LF OU a FN Ostrava.
Předoperační faktory ovlivňující úspěšnost ETV
ETV je indikována na základě obstrukce v likvorových cestách, což je jeden ze základních faktorů, který ovlivňuje úspěšnost ETV. Obstrukci v likvorových cestách nám pomohou odhalit některá ze zobrazovacích vyšetření, v dnešní době především magnetická rezonance (MR) za použití některého z protokolů, které se neustále vyvíjejí. Mezi základní je považováno prohlédnutí sagitálních, ale i ostatních rekonstrukcí v T1 a především v T2 obraze s cílem najít obstrukci v oblasti akveduktu (kde je nejčastější), ale i v oblasti foramen monroi a v místě výtokové části IV. komory. Fenomény průtoku (flow voids) lze dobře odečíst za použití fast spin echo (FSE) T2 zobrazení v sagitální projekci. Takto si můžeme potvrdit průchodnost akveduktu či samotné stomie. Další možností, jak zobrazit průtok a potenciálně jej kvantifikovat, je použití fázového kontrastu (Phase Contrast; PC MR) [13]. PC MR využívá k zobrazení změny fázového posunu pohybujících se protonů v místě zájmu, takto dokáže zobrazit průtok mozkomíšního moku. Tato metoda (flow phase contrast) může také přímo kvantifikovat průtok. Stivaros et al ve své pilotní studii zjistili signifikantně snížený mozkový průtok a současně snížený tok mozkomíšního moku v oblasti foramen magnum u pacientů s úspěšnou ETV ve srovnání s kontrolní skupinou a současně pozorovali zlepšení parametrů po ETV [14]. Vhodné je také použití CISS (Constructive Interference in Steady State) T2 sekvence. Jedná se o sekvenci s vysokým rozlišením zaručující detailnější zobrazení rozhraní mozkomíšního moku a okolních struktur ve srovnání s konvenčním zobrazením. CISS umožňuje lépe odhalit event. obstrukci v likvorových cestách (především v akveduktu).
Úspěšnost ETV kolísá poměrně v širokém rozmezí od 23 – 94 %, s průměrnou úspěšností 68 % v závislosti na věku v době provedení ETV, anamnéze předchozí infekce, intraventrikulárním krvácení, na příčině hydrocefalu či v závislosti na předchozí drenážní operaci [15]. Z radiologických faktorů se nám jeví jako velmi prospěšné zhodnocení předoperačního tvaru III. komory [16 – 20]. Je popisována typická deformace spodiny III. komory a laminy terminalis, jež Dlouhý et al nazývají tzv. bowingem [19]. Bowingem je myšlena deformace spodiny III. komory pod linii spojující střed chiazma a vrchol kmene a laminy terminalis dopředu před linii mezi chiazma a přední komisurou (obr. 1) [19]. Tato deformace má značit tlakový gradient mezi komorovým systémem a subarachnoidálními prostory vlastně tak, jak jsme zvyklí pozorovat dilataci nad překážkou např. u jednokomorového hydrocefalu (obr. 2A) nebo u čtyřkomorovém hydrocefalu při obstrukci výtokové části čtvrté komory (obr. 2B). Ze studií vyplývá, že je‑li přítomen bowing III. komory, je šance na úspěšnost ETV téměř třikrát vyšší než u pacientů s absencí tohoto znaku [16 – 20]. Úspěšnost ETV se známkami bowingu je dle autorů udávána v rozmezí 70,5 – 96 % [18 – 20]. Na druhou stranu je potřeba uvést, že absence bowingu neznamená automaticky selhání ETV, jelikož u zhruba 1/ 3 pacientů je úspěšná [19]. Kehler et al, autoři, kteří jako první pozorovali tento fenomén, pak na základě přítomnosti tří faktorů: bowingu III. komory, viditelné obstrukce v komorovém systému a dynamice symptomů zhotovují pětistupňovou škálu (tab. 2), která predikuje úspěšnost ETV [17]. Pacienti s 1 – 2 body neindikují k ETV, u ostatních pozorovali úspěšnost 40 – 95 %. Po úspěšné ETV lze také pozorovat úpravu tvaru III. komory (obr. 3).
Tab. 2. Kehlerův skórovací systém. Pacienty s 1–2 body neindikuje k ETV, u pacientů s 3 body byla v jeho souboru úspěšnost ETV ve 40 %, se 4 body v 58 %, s 5 body v 95 % [13]. ![Kehlerův skórovací systém.
Pacienty s 1–2 body neindikuje k ETV, u pacientů s 3 body byla v jeho souboru úspěšnost ETV ve 40 %, se 4 body v 58 %, s 5 body v 95 % [13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/1d494b0c72ca66354786200ccdd4074e.jpg)
ETV – endoskopická ventrikulocisternostomie. Obr. 1. Bowing III. komory, tzv. deformace spodiny III. komory pod linii spojující střed chiazma a vrchol kmene a vyklenutí laminy terminalis dopředu před linii mezi chiazma a přední komisuru. 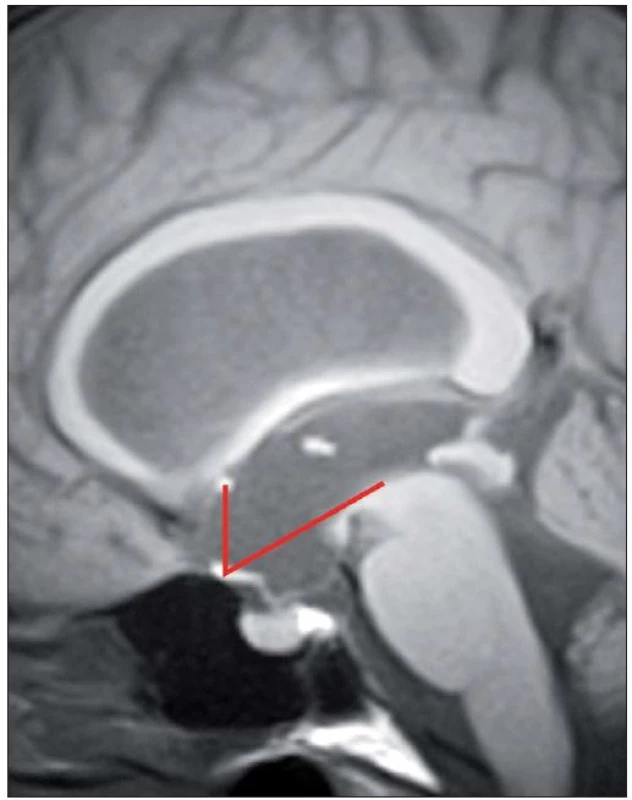
Obr. 2. Ukázka dilatace komorového systému nad překážkou v případě jednokomorového hydrocefalus při uzávěru foramen monroi (a) nebo u čtyřkomorového hydrocefalu při obstrukci výtokové části IV. komory (b). 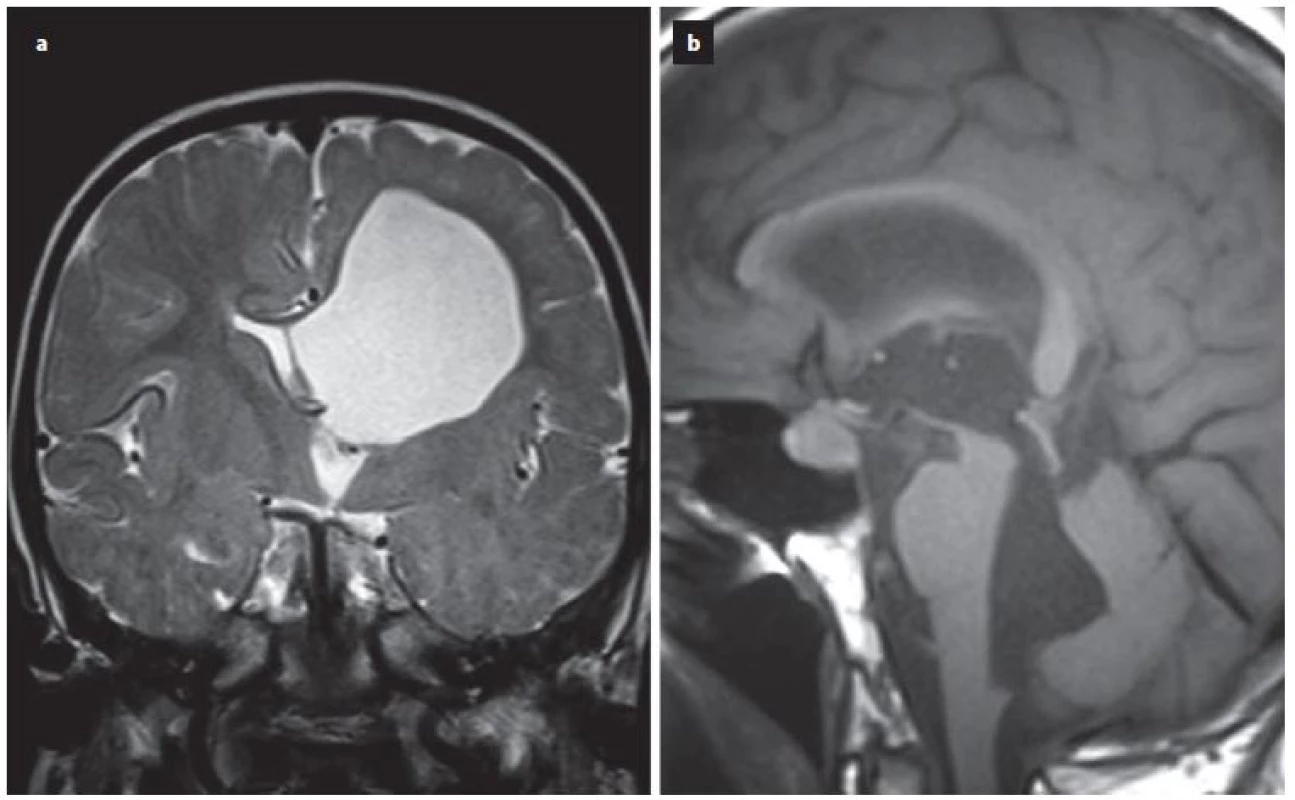
Obr. 3. Vyjádřený bowing III. komory u pacientky se stenózou mokovodu (a), úprava tvaru III. komory po úspěšné ETV (b). 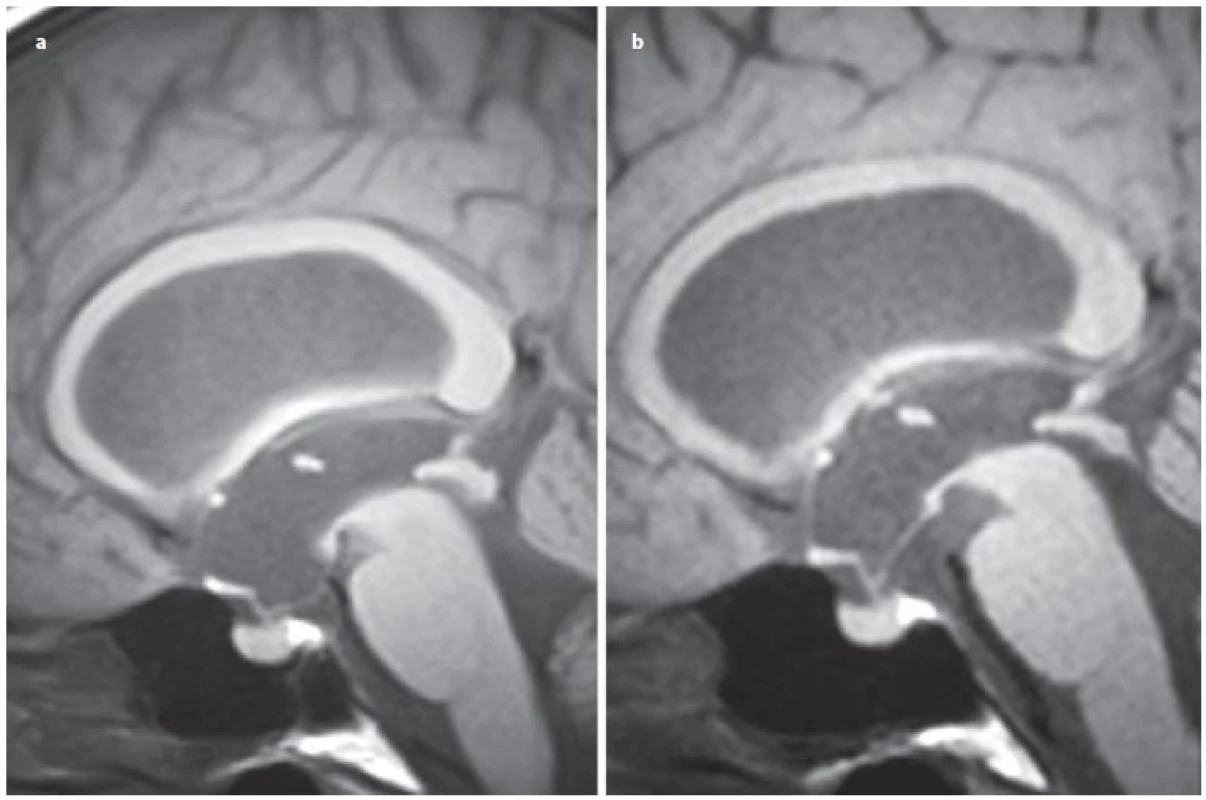
Z dalších radiologických předoperačních měření je rovněž jako prediktor úspěšnosti a bezpečnosti provedení ETV mnohými považována velikost prepontinního prostoru (objem interpedunkulární cisterny), nicméně Souweidane et al na souboru 100 pacientů nepozorovali vliv velikosti tohoto prostoru na úspěšnost EVT, taktéž nezaznamenali vyšší riziko selhání při zašlém prepontinním prostoru [21]. Použití tohoto faktoru tedy nelze doporučit.
Za zásadní jsou považovány mnohé klinické faktory, které ovlivňují míru úspěšnosti ETV. Na základě zhodnocení souboru pacientů a faktorů, jako je věk, etiologie hydrocefalu a předchozí drenážní operace, vytváří Kulkarni et al skóre úspěšnosti ETV (tab. 3) [22]. Schopnost tohoto skóre skutečně predikovat úspěch ETV byla opakovaně potvrzena [23 – 25].
Tab. 3. Kulkarniho skóre úspěšnosti ETV (ETV success score) [18]. Součtem jednotlivých hodnot lze dojít k procentuální pravděpodobnosti úspěšnosti ETV. ![Kulkarniho skóre úspěšnosti ETV (ETV success score) [18].
Součtem jednotlivých hodnot lze dojít k procentuální pravděpodobnosti úspěšnosti ETV.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/4d7652314f50da8e600a57c4117c0896.jpg)
ETV – endoskopická ventrikulocisternostomie Jak lze vyvodit z Kulkarniho úspěšnostního skóre příčina hydrocefalu má významný vliv na úspěšnost ETV. Nejlepších výsledků je dosahováno u pacientů se stenózou mokovodu, kdy úspěšnost, v závislosti na příčině stenózy (vrozená, získaná) a věku, zpravidla přesahuje 80 % [26,27]. Podobných výsledků je dosahováno i u obstrukčního hydrocefalu na podkladě tumoru v zadní části III. komory a zadní jámy [27,28].
Opakovaně je zvažována a někdy i zpochybňována indikace ETV u postinfekčního a posthemoragického hydrocefalu. Recentní studie však prokazují úspěšnost ETV u zhruba 2/ 3 pacientů, a je tedy považována za plně indikovanou [24,29 – 32]. Dle multicentrické studie Siomina et al je udávána úspěšnost ETV u posthemoragického hydrocefalu 60,9 % a u postinfekčního 64,3 %, nicméně významně rizikovou skupinou pacientů pro selhání ETV byli pacienti s kombinací posthemoragického a postinfekčního hydrocefalu, kde autoři pozorovali úspěšnost pouze 23,1 % [30]. Také např. Raouf et al zaznamenali celkovou úspěšnost u 55,9 % pacientů s postinfekčním hydrocefalem, u podskupiny s endoskopicky dokumentovanou obstrukcí mokovodu byla úspěšnost 81,9 % [31]. Z výše uvedeného tedy vyplývá, že selháním ETV jsou ohroženi především pacienti s kombinací posthemoragického a postinfekčního hydrocefalu.
Za zásadní faktor ovlivňující úspěch ETV je považován věk v době provedení ETV. Obecně nižší úspěšnosti je dosahováno u dětí stáří do 6 – 24 měsíců [33,34]. Nicméně i zde je dosahováno úspěšnosti převyšující 50 %, což potvrzuje i naše zkušenost [33,34]. Přesto je věk v době operace považován za prediktivní faktor úspěšnosti EVT. Důvodem vyššího rizika časného selhání u této skupiny pacientů je pravděpodobně „nevyzrálá“ absorpční kapacita [29], ale také vyšší tendence k spontánnímu uzávěru stomie a novotvorbě neo ‑ membrán v interpedunkulární cisterně, jak ve své práci prokazují Wagner et al [35]. Ti (ve svém souboru 11 pacientů stáří do jednoho roku) prokázali při opakované ETV (re‑EVT) časný uzávěr stomie nebo formaci nové membrány v cisterně. Tento nález nás vede k zamyšlení, zda i u pacientů s časným selháním neprovádět pooperační MR k vyloučení obstrukce stomie a při pozitivním nálezu neprovádět re‑EVT.
Pacienti po předchozí implantaci ventrikuloperitoneální drenáže (VP drenáže) byli dříve považováni za nevhodné kandidáty pro ETV. Bylo zažito paradigma, že „jednou implantovaný shunt znamená navždy shunt“ [29]. Existovaly obavy, že odvádění mozkomíšního moku mimo komorový systém naruší mechanizmus jeho fyziologické absorpce. Tyto domněnky se však nepotvrdily a celá řada pozorování, včetně naší zkušenosti, ukazují vysokou úspěšnost ETV jako alternativy řešení selhání VP drenáže [30,36,37]. Zvažujeme‑li provedení ETV při selhání drenáže, není ani tak důležitá původní etiologie hydrocefalu jako známky obstrukce v likvorových cestách v době selhání drenáže [29]. Po zkratové operaci může dojít k sekundární stenóze mokovodu u původně komunikujícího hydrocefalu [29]. Celá řada autorů pak uvádí dokonce vyšší úspěšnost ETV po zkratové operaci než u primárně provedené ETV u posthemoragického nebo postinfekčního hydrocefalus [30,36,37]. Například O’Brien et al pozorovali zlepšení úspěšnosti ETV z 27 % na 71 % u posthemoragického hydrocefalu a z 0 na 75 % u postinfekčního hydrocefalu [36]. V našem souboru 36 dětských pacientů jsme pozorovali celkovou úspěšnost 72 %. U pacientů s posthemoragickým hydrocefalem po selhání VP shuntu byla úspěšnost 64 %, v případě devíti pacientů, u kterých byla již v minulosti provedena neúspěšná ETV, byla úspěšnost 56 % [37]. Z výše uvedeného vyplývá, že k ETV jsou indikováni ti pacienti se selháním VP shuntu, kteří mají v době selhání radiologické známky obstrukčního hydrocefalu, bez ohledu na původní příčinu hydrocefalu. Stejně tak původní neúspěšná EVT není kontraindikací.
Někteří autoři se zabývají výzkumem celé řady biomarkerů vyšetřovaných v mozkomíšním moku. Některé z nich je možné použít v diagnostice hydrocefalu [38 – 41]. Z těchto biomarkerů vyjmenujme například NFL protein (Neurofilament Light Protein), MPB protein (Myelin Basic Protein), izoformy β ‑ amyloidu, rozpustný amyloidový prekurzor, které jsou užívány především v diagnostice normotenzního hydrocefalu [40]. U pacientů s normotenzním hydrocefalem lze v mozkomíšním moku nalézt také zvýšené hladiny homocysteinu [39]. V případě akutního hydrocefalu je uváděna zvýšená koncentrace atriálního natriuretického peptidu (ANP) nebo arginin vasopresinu (AVP) v mozkomíšním moku [38]. Jedna z mála studií věnující se možnosti predikce úspěšnosti EVT na základě vyšetření hladin biomarkeru v mozkomíšním moku je práce našeho pracoviště [41]. V naší studii jsme na souboru 29 pacientů posuzovali vliv koncentrace transformujícího růstového faktoru beta 1 (TGF‑β1) na úspěšnost ETV. Soubor tvořili nezralí novorozenci s posthemoragickým hydrocefalem a prokázanou obstrukcí likvorových cest na MR. Koncentrace TGF‑β1 byla stanovována z mozkomíšního moku v době implantace Ommaya rezervoáru. U pacientů s hladinou TGF‑β1 pod 3,296 pg/ ml byla úspěšnost EVT 100 %, hodnoty přesahující 3,296 pg/ ml znamenaly 81,3% pravděpodobnost přítomnosti hyporesorbce a tedy selhání EVT [41].
Souhrn – předoperační faktory
NEGATIVNĚ ovlivňující úspěšnost ETV:
- věk do jednoho roku,
- kombinace posthemoragického a postinfekčního hydrocefalu,
- absence nálezu obstrukce v komorovém systému,
- absence bowingu III. komory.
POZITIVNĚ ovlivňující úspěšnost ETV:
- věk nad jeden rok,
- přítomnost obstrukce v komorovém systému,
- přítomnost bowingu III. komory,
- vyšší hodnota ETV skóre úspěšnosti,
- stenóza mokovodu, event. obstrukce tumorem v oblasti výtokové částí III. komory,
- hladina TGF‑β1 pod 3,296 pg/ ml v mozkomíšním moku (u pacientů s posthemoragickým hydrocefalem).
Perioperační faktory ovlivňující úspěšnost ETV
Celá řada perioperačních faktorů a jejich vliv na úspěšnost ETV je diskutována. Nejčastěji bývá uváděna absence pulzace spodiny III. komory, přítomnost adhezí v subarachnoidálním prostoru, ale i další faktory, které negativně ovlivňují úspěšnost ETV [42 – 45]. Greenfield et al hodnotí svůj soubor 109 pacientů na základě přítomnosti tří perioperačních rizikových faktorů selhání ETV: abnormální anatomie III. komory, přítomnost ztluštělých membrán v subarachnoidálním prostoru a absence pulzace spodiny III. komory po vytvoření stomie [42]. U pacientů, u kterých nebyl žádný ze znaků přítomen, byla úspěšnost 88 %. U pacientů s jedním rizikovým faktorem EVT selhala v 71 %, u pacientů se dvěma a více faktory EVT selhala ve 100 %, u žádného pacienta s absencí pulzace spodiny III. komory nebyla EVT úspěšná. Romero et al pak ke třem výše uvedeným faktorům doplňují ještě přítomnost Liliequistovy membrány a její perforaci, kalný likvor nebo větší perioperační krvácení a nutnost koagulace okrajů stomie za účelem retrakce spodiny pro její nadbytečnou velikost [44]. Je všeobecně uznáváno, že je‑li přítomna Liliequistova membrána, musí být vždy protnuta, jelikož by v opačném případě bránila komunikaci mezi III. komorovou a cisternami. Dle Romera et al riziko selhání EVT silně koreluje s počtem rizikových faktorů, především pak s absencí pulzace spodiny III. komory po ETV, stejně tak s přítomností tuhých membrán v subarachnoidálním prostoru a s přítomností Liliequistovy membrány [44]. Také Kombogiorgas et al ve své studii potvrzují, že přítomnost adhezí v cisterně a dále i ztluštění spodiny III. komory negativně ovlivňuje úspěšnost ETV [45]. K dalšímu zajímavému zjištění dochází ve chvíli, kdy srovnávají šířku stomie (poměrně k velikosti vzdálenosti mezi klinoidálním výběžkem a bazilární arterií – vyjádřeno v procentech) u úspěšné a neúspěšné ETV. Zjišťují, že u pacientů bez předchozí zkratové operace, s velikostí stomie nad 30 % (z výše uvedené distance), je vyšší úspěšnost ETV [45].
Warf považuje známky excesivního, postinfekčního zajizvení subarachnoidálních prostor zjištěných během endoskopie za významný rizikový faktor selhání ETV a u těchto pacientů rovnou provádí VP drenáž [32]. Warf et al také uvádí vyšší úspěšnost ETV v kombinaci s koagulací choroidálního plexu (KCHP) ve srovnání se samotnou ETV, a to především u dětí do stáří jednoho roku a s kongenitální stenózou mokovodu (úspěšnost u samostatné ETV 48,6 vs. 81,9 % u kombinace ETV + KCHP) [46]. Ještě výrazně lepších výsledků Warf dosahuje u dětí stáří do dvou let s idiopatickým, komunikujícím hydrocefalem, kdy u prosté ETV pozoroval úspěšnost 20 a 72,4 % u ETV + KCHP, což je velmi překvapivé až kontroverzní zjištění [47]. Nicméně soubor autora tvořil vcelku reprezentativní počet 64 dětí, přičemž 16 dětí podstoupilo prostou ETV a 48 dětí ETV + KCHP, při průměrné době sledování 34,4 měsíce [47]. Příčinu úspěšnosti této metody vidí ve zvýšené poddajnosti mozku (compliance) u těchto pacientů. Po ETV + KCHP dochází k zmírnění vlivu pulzních vln na mozkový parenchym (ETV pomáhá absorbovat pulzace a KCHP redukuje pulzní vlny) [47].
Pozorování pulzace spodiny III. komory se věnují také Kamel et al. Uvádí vyšší úspěšnost u pacientů s pulzací spodiny po ETV a současně publikují tzv. hydrostatický test na souboru 30 pacientů [48]. Po provedení stomie uzavírají výtokový port endoskopu a provádí irigaci po dobu 10 s, následně přerušují irigaci a otevírají výtokový port, za pozitivní považují vyklenutí spodiny do III. komory proudem nakumulované tekutiny v bazálních cisternách. U pacientů s perioperační známkou pulzace spodiny a s pozitivním „hydrostatickým testem“ uvádí úspěšnost ETV 86,9 %, u pacientů s absencí obou uvedených znaků pozorovali úspěšnost pouze ve 14,2 % [48].
Demonstraci využití perioperační MR, respektive MR ventrikulografie v endoskopické léčbě hydrocefalu uvádí Tabakow et al na souboru 11 pacientů [49]. I z takto malého souboru pacientů lze vyvodit klinický přínos této metody. Perioperační MR ventrikulografie před provedením vlastní ETV nám může potvrdit místo obstrukce v likvorových cestách. Naopak po provedení ETV můžeme perioperační MR ventrikulografií potvrdit patenci stomie. Dle autorů byl u dvou pacientů zaznamenán slabý průtok kontrastní látky stomií, u těchto pacientů došlo k selhání ETV. U dalších dvou pacientů ovlivnila MR ventrikulografie další postup chirurga. U prvního pacienta byly nalezeny těžké adheze v cisternách – ventrikulografie však prokázala zcela volný průchod kontrastní látky přes stomii a oblast cisteren, což vedlo chirurga k přerušení dalšího rozrušování adhezí v cisternách. U dalšího pacienta ventrikulografie po ETV prokázala omezený průtok stomií a oblastí cisteren – rozšíření velikosti stomie a rozrušení intracisternálních adhezí vedlo ke zlepšení ventrikulografického nálezu, u obou pacientů byla ETV úspěšná. Komplikace ve spojitosti s nitrokomorovou aplikací kontrastní látky nebyly pozorovány (gadoteridol 0,5 mmol/ ml v ředění 1 : 40).
V poslední řadě je nutné se zmínit o technickém selhání z příčin, jež znemožňují samotný operační výkon. Důvody, jež vedou k předčasnému ukončení ETV, jsou především anatomické anomálie komorového systému, které neumožňují orientaci a provedení ETV. Operace také může být předčasně ukončena pro krvácení, které znemožní viditelnost. V některých případech se nezdaří samotný průnik do komorového systému (při použití MR navigace vzácné, navíc z podstaty hydrocefalu lze ve většině případů očekávat ventrikulomegalii), event. může dojít k selhání přístrojové techniky. Proto je vždy nutná její kontrola před začátkem výkonu.
Souhrn – perioperační faktory
NEGATIVNĚ ovlivňující úspěšnost ETV:
- absence pulzace spodiny III. komory po ETV;
- četné adheze/ membrány v cisterně (přítomnost Liliequistovy membrány);
- anatomické anomálie komorového systému, perioperační krvácení nebo technická chyba provedení.
POZITIVNĚ ovlivňující úspěšnost ETV:
- pulzace spodiny III. komory,
- „hydrostatický test“,
- koagulace choroidálních plexů postranních komor spolu s ETV,
- použití perioperační MR ventrikulografie,
- šířka stomie (alespoň 30 % vzdálenosti mezi klinoidem a bazilární arterií).
Pooperační faktory ovlivňující úspěšnost ETV
V pooperačním období, které bývá také nazýváno jako adaptační, je zásadní sledování klinického stavu po provedené ETV a nález na kontrolním zobrazovacím vyšetření (především MR). Přetrvávání klinických známek hydrocefalu značí selhání ETV. Selhání lze rozdělit jako časné a pozdní. Za časné je většinou autorů považováno selhání do tří měsíců po ETV. Bylo opakovaně zjištěno, že má‑li ETV selhat, nastává tak především v prvních týdnech po ETV. Pozdní selhání jsou vzácná [6,7,26]. Časné selhání může mít celou řadu příčin (špatná indikace, přítomnost poruchy resorpce, špatné provedení atd.). Pozdní selhání je ve většině případů na podkladě okluze stomatu [5,35]. Současně se předpokládá, že vyšší tendenci k spontánnímu uzávěru stomie mají děti, jak uvádí Wagner et al [35]. Ti, upozorňují na možnost časného uzávěru stomie u dětí stáří do jednoho roku. [35]. Vyšší četnost časného selhání uvádějí i jiní autoři. Faggin et al pozorují časné selhání u 17 z 84 pacientů s mediánem 57 dnů, u zbývajících 67 pacientů zaznamenávají pozdní selhání u pěti pacientů s mediánem 5 let. Incidence pozdního selhání byla vyšší u pacientů s postinfekčním hydrocefalem [6]. Ze zkušeností Santamarty et al vyplývá, že má‑li dojít k selhání ETV, dochází k němu v prvních 16 dnech po ETV v 90 % [7]. Salvador et al na souboru 168 pacientů zjistili, že 19 % pacientů selhalo v prvním měsíci a pouze 5,4 % v období více než jeden měsíc po ETV [27]. Kulkarami et al srovnávají četnost selhání ETV se selháním VP drenáží [9,50]. Zjistili, že relativní riziko selhání ETV je oproti zkratové operaci vyšší v prvních třech měsících, avšak v další době riziko selhání ETV progresivně klesá a naopak četnost selhání VP drenáží se zvyšuje [9,50].
Jednou ze známek selhání ETV je přetrvávání zvýšeného intrakraniálního tlaku (ICP). Jeho pooperační monitorací se zabývá celá řada autorů. Jednou z možností monitorace ICP po provedené ETV je zavedení „pojistné“ zevní komorové drenáže (ZKD) a v případě potřeby odpuštěním mozkomíšního moku ICP korigovat. Například Roytowski et al uvádí pozitivní prediktivní hodnotu (PPV) pooperačního sledování ICP pomocí ZKD 76,3 % a negativní prediktivní hodnotu (NPV) 100 % [51]. Metodu také srovnávají s vlivem intraoperačního dojmu chirurga na očekávanou úspěšnost ETV (přítomnost adhezí, pulzace spodiny atd.), kdy dosahuje podobné PPV 76,5 % a NPV 76,9 % [51]. Je však nutné uvést nejčastější komplikaci ZKD, tzv. infekční komplikace, které sám Roytkowski et al pozorovali v 11,7 % [51]. Sledování ICP po ETV se také věnují Cinalli et al, kteří po více než polovině ETV pozorovali přetrvávání zvýšeného ICP v prvním pooperačním dnu, přičemž jeho pokles byl v dalších dnech jen pozvolný s normalizací za 2 – 9 dnů [52]. U pacientů s přetrvávající elevací ICP a současně vyjádřenými klinickými známkami hydrocefalu pomohla opakovaná, odlehčující lumbální punkce překlenout toto období, přičemž u těchto pacientů byla následně ETV hodnocena jako úspěšná [52]. Lumbální punkce by tedy u některých pacientů mohla pomoci překlenout „adaptační“ období po EVT a zvýšit tak její úspěšnost. V podobné studii Ozisik et al využívají zevní lumbální drenáž (ZLD) u selektivně vybraných pacientů – s trvajícími známkami elevace ICP, nebo profylakticky (např. pro krvácení po biopsii apod.) [53]. Zaměříme‑li se pouze na 12 pacientů s přetrvávajícími známkami hydrocefalu po zavedení ZLD na dobu 24 – 48 hod, byla úspěšnost ETV 85 %. Bez použití ZLD by pravděpodobně velká část z nich byla hodnocena jako selhání ETV a byla by u nich provedena drenážní operace [53]. Budoucností monitoringu ICP u pacientů s hydrocefalem by mohla být čidla s telemetrickým přenosem dat [54]. Za důsledek přetrvávání zvýšeného ICP pooperačně lze považovat i zvýšenou incidenci likvorey u pacientů se selháním ETV. Dle výsledků Kombogiorgase et al je pooperační likvorea silně asociována s přítomností selhání ETV [45].
Zajímavé jsou výsledky likvoro‑dynamických testů před a po provedené ETV zkoumající odporovou rezistenci (Rout) a cerebrospinální elastanci [55,56]. Tisell et al ve své studii sledují několik faktorů: vliv hodnot Rout zjištěné při lumbálním infuzním testu (LIT) a komorovém infuzním testu (VIT) těsně před ETV, prediktivní hodnotu elastance, jak se změní Rout a elastance po ETV, současně hodnotí i změnu velikosti komor po ETV [56]. Uvádí, že Rout zjištěná při předoperačním VIT a LIT se signifikantně nelišila, pokles Rout při kontrole po třech měsících koreloval s úspěšností ETV, nebyla nalezena žádná korelace mezi předoperační Rout a klinickým výsledkem. Vysoká elastance korelovala s úspěšností ETV, nicméně zůstala nezměněna. Elastance byla dále spojena s redukcí šíře III. komory, které silně korelovalo s úspěšností EVT. Vajda et al využívají index pulzatility (PI) měřeného pomocí dopplerovské transkraniální sonografie [57]. U pacientů s úspěšnou ETV pozorují signifikantní snížení PI, což korelovalo s MR potvrzeným průtokem stomií.
Další studie se věnují vlivu pooperačního radiologického nálezu na úspěšnost EVT. Sleduje se především detekce přítomnosti toku stomií, redukce šíře komor, redukce periventrikulárního edému a další znaky v korelaci s klinickým úspěchem ETV [58 – 63]. Nález flow ‑ void fenoménu v místě stomie či jeho detekce pomocí PC MR koreluje s úspěšností ETV (obr. 4) [59,63]. Například ve studii Kulkarniho et al byl průtok stomií detekován u 94 % klinicky úspěšných ETV, kdežto pouze u 25 %, u kterých ETV selhala [59]. Nicméně je nutné mít na paměti, že absence toku stomií neznamená automaticky selhání ETV a naopak [5,59]. Bargallo et al zjistili závislost mezi objemem průtoku stomií a úspěšností ETV při vyšetření fázovým kontrastem [62]. Objem průtoku stomií větší než 75 mm3 koreloval s úspěšností EVT se senzitivitou 76,7 % a specificitou 87,5 % [62]. Z jiných pozorování vyplývá, že k redukci šíře komor může dojít jak u pacientů s úspěšnou ETV, tak i u pacientů se selháním. Nicméně redukce šíře komor je signifikantně vyšší u pacientů s úspěšnou ETV. Kulkarni et al opět pozorovali redukci šíře komor u 16 % úspěšně léčených pacientů, kdežto jen u 7 % se selháním ETV, avšak k redukci šíře komor o více než 15 % původní šířky došlo jen u 48 % úspěšně léčených pacientů [59]. Kulkarni et al používají ve své studii tzv. frontal ‑ occipital horn ratio (největší šířka frontální + okcipitálních rohů//největším biparietálním rozměrem), tento poměr by měl nejlépe korelovat s objemem komor (normální hodnota 0,36 – 0,38) [59,64]. Di Rocco et al využívají MR volumometrie k sledování objemu komor po ETV [58]. Po úspěšné ETV došlo k zmenšení objemu komorového systému třetí pooperační den na 76 % původního objemu, dále na 69 % původního objemu po dvou týdnech, na 42 % ve dvou měsících a na 40 % v šesti měsících po úspěšné ETV [58]. Taktéž pozorovali, že po úspěšné ETV došlo v průměru ke zvětšení objemu subarachnoidálních prostor na 192 % původního objemu třetí pooperační den, na 210 % po dvou týdnech, na 428 % po dvou měsících a na 468 % po šesti měsících [58]. Z výsledků je patrné, že úprava velikosti komorového systému a restaurace cirkulace mozkomíšního moku je spíše pozvolná, a lze ji tedy očekávat v delším časovém horizontu. V jiné studii se Pindrik et al zabývají změnou velikosti šířky III. komory a plochy jejího příčného průřezu. Prokazují v průměru o 17,4 % (0,32 cm) zmenšení šířky III. komory po úspěšné ETV a v průměru rozšíření o 21 % (0,35 cm) při jejím selhání [65]. Současně pozorovali snížení příčné plochy III. komory po úspěšné ETV o 19,7 % (1,85 cm2) a zvýšení o 17,3 % (1,17 cm2) při selhání ETV [65]. Buxton et al se také zabývají vlivem změny tvaru III. komory na úspěšnost ETV [66]. Ve svém souboru 38 pacientů, s mediánem sledování 1,65 měsíce, uvádí jako faktor s nejvyšší PPV 88 % redukci distance mezi přední a zadní komisurou, redukce šířky III. komory měla v tomto souboru PPV 73 % a redukce šířky III. komory 68 % [66]. Z výše uvedených pozorování vyplývá, že redukce komorového systému a rozšíření subarachnoidálních prostor je pozvolné a trvá zpravidla několik týdnů. Proto nepovažujeme tyto faktory jako ideální k hodnocení předpovědí časného selhání ETV.
Obr. 4. Flow-void fenomén prokazující průtok stomií po úspěšné ETV (označeno šipkou). 
Souhrn – pooperační faktory
NEGATIVNĚ ovlivňující úspěšnost ETV:
- přítomnost pooperační likvorey,
- absence průtoku stomií po ETV.
POZITIVNĚ ovlivňující úspěšnost ETV:
- přítomnost průtoku stomií na pooperačním MR,
- klinicky úspěšná ETV tři měsíce po provedení,
- lumbální punkce, event. zevní lumbální drenáž po provedené ETV mohou zvýšit její úspěšnost,
- pokles Rout při kontrole po třech měsících koreluje s úspěšností ETV, vysoká předoperační elastance koreluje s úspěšností ETV, taktéž snížení indexu pulzatility (měřeno dopplerovskou sonografií) po úspěšné ETV,
- redukce komorového systému a zvětšení objemu subarachnoidálních prostor (avšak v dlouhodobém horizontu!) koreluje s úspěšnou ETV,
- pooperační monitorace ICP.
Komplikace ETV
ETV je považována za bezpečnou proceduru s nízkým počtem komplikací. Přesto však jsou komplikace ve spojitosti s touto technikou popisovány a každý chirurg, který tento typ výkonu provádí, by s nimi měl být předem seznámen. V metaanalýze 2 985 provedených ETV byl zjištěn celkový počet komplikací u 8,5 % výkonů [67]. Přičemž k trvalé morbiditě došlo u 2,38 % z nich, z toho v 1,44 % došlo k trvalému neurologickému deficitu (převážně k okohybné poruše u téměř poloviny pacientů) a v 0,94 % byla způsobena hormonální porucha. Mortalita ETV bývá uváděna zpravidla do 1 %. V námi citovaném souboru pacientů je mortalita 0,28 % (osm úmrtí). U dvou pacientů byla příčina úmrtí sepse, u čtyř pacientů krvácení a u dvou pacientů došlo k pozdnímu, náhlému úmrtí v důsledku uzávěru stomie (0,07 % v tomto souboru). Perioperační krvácení bylo zaznamenáno v 3,72 %, z toho závažné v 0,6 %. Z pooperační komplikací jsou uváděny především intrakraniální krvácení v 0,81 %, likvorea v 1,61 %, neuroinfekce v 1,81 %. Často uváděné teploty (kolem 40 °C) první pooperační den po ETV jsou dle našich zkušeností zcela raritní. Příčinou je pravděpodobně podráždění hypothalamu. Ve výše uvedené metaanalýze nebyl zjištěn signifikantní rozdíl komplikací v souboru dětských a dospělých pacientů, taktéž se nelišily soubory s počtem do a nad 100 pacientů [67].
Závěr
ETV III. komory se jeví jako velmi úspěšná metoda v léčbě vybraných pacientů s hydrocefalem v dětském i dospělém věku. Ve srovnání s drenážní operací znamená pro společnost nižší ekonomickou zátěž a z dlouhodobého pohledu menší počet komplikací. I přesto, že pozdní selhání jsou vzácná, je nutné pacienty po úspěšné ETV trvale dispenzarizovat (tab. 4). Úspěšnost ETV je závislá na celé řadě faktorů, především pak na správné klinické indikaci, ale i na radiologickém a perioperačním nálezu. Jelikož úspěšnost ETV v jednotlivých souborech kolísá v závislosti na jejich složení, je nadále nutné pracovat na zpřesnění indikačních kritérií a podporovat výzkum v této oblasti.
Tab. 4. Způsob dispenzarizace pacientů po ETV na Neurochirurgické klinice LF OU a FN Ostrava. 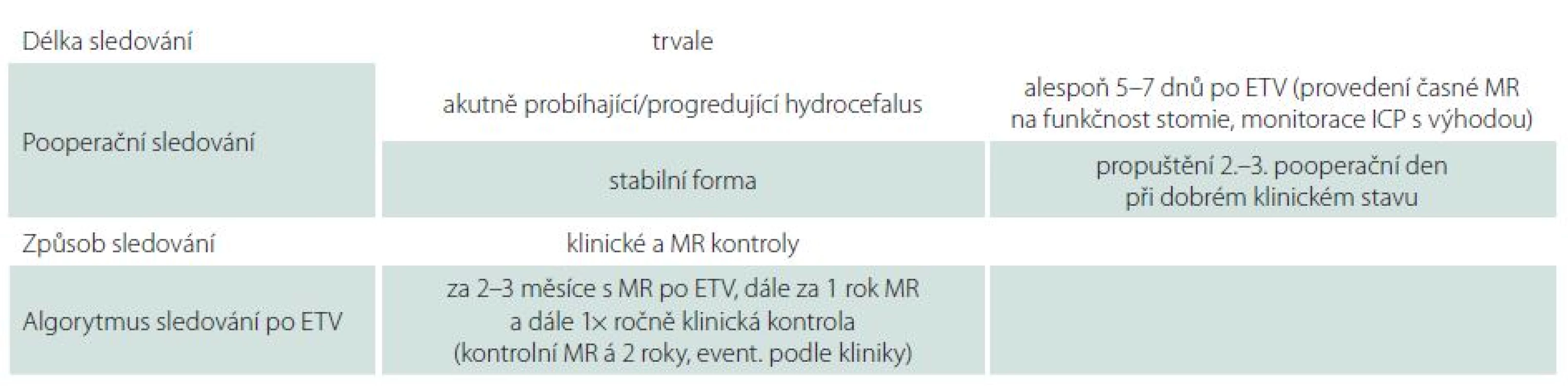
ETV – endoskopická ventrikulocisternostomie, MR magnetická rezonance, ICP – intrakraniální tlak.
Zdroje
1. Rekate HL, Nadkarni TD, Wallace D. The importance of the cortical subarachnoid space in understanding hydrocephalus. J Neurosurg Pediatr 2008; 2(1): 1 – 11. doi: 10.3171/ PED/ 2008/ 2/ 7/ 001.
2. Dlouhy BJ, Capuano AW, Madhavan K, Torner JC, Greenlee JD. Preoperative third ventricular bowing as a predictor of endoscopic third ventriculostomy success. J Neurosurg Pediatr 2012; 9(2): 182 – 190. doi: 10.3171/ 2011.11.PEDS11495.
3. Hailong F, Guangfu H, Haibin T, Hong P, Yong C, Weidong L et al. Endoscopic third ventriculostomy in the management of communicating hydrocephalus: a preliminary study. J Neurosurg 2008; 109(5): 923 – 930. doi: 10.3171/ JNS/ 2008/ 109/ 11/ 0923.
4. Rangel ‑ Castilla L, Barber S, Zhang YJ. The role of endoscopic third ventriculostomy in the treatment of communicating hydrocephalus. World Neurosurg 2012; 77(3 – 4): 555 – 560. doi: 10.1016/ j.wneu.2011.06.038.
5. Cinalli G, Sainte ‑ Rose C, Chumas P, Zerah M, Brunelle F, Lot G et al. Failure of third ventriculostomy in the treatment of aqueductal stenosis in children. J Neurosurg 1999; 90(3): 448 – 454.
6. Faggin R, Calderone M, Denaro L, Meneghini L, d‘Avella D. Long‑term operative failure of endoscopic third ventriculostomy in pediatric patients: the role of cine phase ‑ contrast MR imaging. Neurosurg Focus 2011; 30(4): E1. doi: 10.3171/ 2011.1.FOCUS10303.
7. Santamarta D, Díaz Alvarez A, Gonçalves JM, Hernández J. Outcome of endoscopic third ventriculostomy. Results from an unselected series with noncommunicating hydrocephalus. Acta Neurochir (Wien) 2005; 147(4): 377 – 382.
8. Lipina R, Palecek T, Reguli S, Kovarova M. Death in consequence of late failure of endoscopic third ventriculostomy. Childs Nerv Syst 200; 23(7): 815 – 819.
9. Kulkarni AV, Drake JM, Kestle JR, Mallucci CL, Sgouros S, Constantini S. Endoscopic third ventriculostomy vs cerebrospinal fluid shunt in the treatment of hydrocephalus in children: a propensity score‑adjusted analysis. Neurosurgery 2010; 67(3): 588 – 593. doi: 10.1227/ 01.NEU.0000373199.79462.21.
10. Bauer BL. Historical Trends of Neuroendoscopic Surgery. In: Sgouros S (ed.). Neuroendoscopy, current status and future trends. Springer 2014 : 1 – 10.
11. Cinalli G. Endoscopic third ventriculostomy. In: Cinalli G, Maixner WJ, Sainte ‑ Rose C (eds). Pediatric Hydrocephalus. Springer 2004 : 361 – 388.
12. Dandy WE. Diagnosis and treatment of strictures of the aqueduct of Sylvius (causing hydrocephaus). Arch Surg 1945; 51 : 1 – 14.
13. Vybíhal V. Chirurgická léčba hydrocefalu. Cesk Slov Neurol N 2014; 77/ 110(1): 7 – 22.
14. Stivaros SM, Sinclair D, Bromiley PA, Kim J, Thorne J, Jackson A. Endoscopic third ventriculostomy: predicting outcome with phase ‑ contrast MR imaging. Radiology 2009; 252(3): 825 – 832. doi: 10.1148/ radiol.2523081398.
15. Di Rocco C, Frassanito P, Massimi L, Tamburrini G. Prediction of outcome of endoscopic third ventriculostomy. World Neurosurg 2013; 80(5): 509 – 511. doi: 10.1016/ j.wneu.2013.02.037.
16. Kehler U, Gliemroth J. Extraventricular intracisternal obstructive hydrocephalus. A hypothesis to explain successful 3rd ventriculostomy in communicating hydrocephalus. Pediatric Neurosurg 2003; 38(2): 98 – 101.
17. Kehler U, Regelsberger J, Gliemroth J, Westphal M. Outcome prediction of third ventriculostomy: a proposed hydrocephalus grading system. Minim Invasive Neurosurg 2006; 49(4): 238 – 243.
18. Foroughi M, Wong A, Steinbok P, Singhal A, Sargent MA, Cochrane DD. Third ventricular shape: a predictor of endoscopic third ventriculostomy success in pediatric patients.Clinical article. J Neurosurg Pediatr 2011; 7(4): 389 – 396. doi: 10.3171/ 2011.1.PEDS10461.
19. Dlouhy BJ, Capuano AW, Madhavan K, Torner JC, Greenlee JD. Preoperative third ventricular bowing as a predictor of endoscopic third ventriculostomy success. J Neurosurg Pediat 2012; 9(2): 182 – 190. doi: 10.3171/ 2011.11.PEDS11495.
20. Vogel TW, Bahuleyan B, Robinson S, Cohen AR. The role of endoscopic third ventriculostomy in the treatment of hydrocephalus. J Neurosurg Pediatr 2013; 12(1): 54 – 61. doi: 10.3171/ 2013.4.PEDS12481.
21. Souweidane MM, Morgenstern PF, Kang S, Tsiouris AJ,Roth J. Endoscopic third ventriculostomy in patients with a diminished prepontine interval. J Neurosurg Pediatr 2010; 5(3): 250 – 254. doi: 10.3171/ 2009.10.PEDS09187.
22. Kulkarni AV, Drake JM, Mallucci CL, Sgouros S, Roth J, Constantini S. Endoscopic third ventriculostomy in the treatment of childhood hydrocephalus. J Pediatr 2009; 155(2): 254 – 259. doi: 10.1016/ j.jpeds.2009.02.048.
23. Kulkarni AV, Riva ‑ Cambrin J, Browd SR. Use of the ETV Success Score to explain the variation in reported endoscopic third ventriculostomy success rates among published case series of childhood hydrocephalus. J Neurosurg Pediatr 2011; 7(2): 143 – 146. doi: 10.3171/ 2010.11.PEDS10296.
24. Furlanetti LL, Santos MV, de Oliveira RS. The success of endoscopic third ventriculostomy in children: analysis of prognostic factors. Pediatr Neurosurg 2012; 48(6): 352 – 359. doi: 10.1159/ 000353619.
25. Naftel RP, Reed GT, Kulkarni AV, Wellons JC. Evaluating the Children‘s Hospital of Alabama endoscopic third ventriculostomy experience using the Endoscopic Third Ventriculostomy Success Score: an external validation study. J Neurosurg Pediatr 2011; 8(5): 494 – 501. doi: 10.3171/ 2011.8.PEDS1145.
26. Mugamba J, Stagno V. Indication for endoscopic third ventriculostomy. World Neurosurg 2013; 79 (Suppl 2): S20.e19 – S20.e23. doi: 10.1016/ j.wneu.2012.02.016.
27. Salvador SF, Oliveira J, Pereira J, Barros H, Vaz R. Endoscopic third ventriculostomy in the management of hydrocephalus: outcome analysis of 168 consecutive procedures. Clin Neurol Neurosurg 2014; 126 : 130 – 136. doi: 10.1016/ j.clineuro.2014.08.037.
28. Wong TT, Liang ML, Chen HH, Chang FC. Hydrocephalus with brain tumors in children. Childs Nerv Syst 2011; 27(10): 1723 – 1734. doi: 10.1007/ s00381 - 011 - 1523 - 9.
29. Cinalli G, Spennato P. Controversies in the endoscopic management of the various forms of hydrocephalus. In: Sgouros S (ed.). Neuroendoscopy, current status and future trends. Springer 2014 : 47 – 56.
30. Siomin V, Cinalli G, Grotenhuis A, Golash A, Oi S, Kothbauer K et al. Endoscopic third ventriculostomy in patients with cerebrospinal fluid infection and/ or hemorrhage. J Neurosurg 2002; 97(3): 519 – 524.
31. Raouf A, Zidan I, Mohamed E. Endoscopic third ventriculostomy for post‑inflammatory hydrocephalus in pediatric patients: is it worth a try? Neurosurg Rev 2015; 38(1): 149 – 155. doi: 10.1007/ s10143 - 014 - 0582 - 2.
32. Warf BC. Hydrocephalus in Uganda: the predominance of infectious origin and primary management with endoscopic third ventriculostomy. J Neurosurg 2005; 102 (Suppl 1): 1 – 15.
33. Constantini S, Sgouros S, Kulkarni AV. Neuroendoscopy in infants and the international infant hydrocephalus study (IIHS). In: Sgouros S (ed.). Neuroendoscopy, current status and future trends. Springer 2014 : 31 – 46.
34. Lipina R, Reguli S, Dolezilová V, Kuncíková M, Podesvová H. Endoscopic third ventriculostomy for obstructive hydrocephalus in children younger than 6 months of age: is it a first ‑ choice method? Childs Nerv Syst 2008; 24(9): 1021 – 1027. doi: 10.1007/ s00381 - 008 - 0616 - 6.
35. Wagner W, Koch D. Mechanisms of failure after endoscopic third ventriculostomy in young infants. J Neurosurg 2005; 103 (Suppl 1): 43 – 49.
36. O‘Brien DF, Javadpour M, Collins DR, Spennato P, Mallucci CL. Endoscopic third ventriculostomy: an outcome analysis of primary cases and procedures performed after ventriculoperitoneal shunt malfunction. J Neurosurg 2005; 103 (Suppl 5): 393 – 400.
37. Lipina R, Hrbac T, Chlachula M, Krejci T, Kunčikova M. Endoskopická ventrikulocisternostomie u děti s předchozí implantací ventrikuloperitoneální drenáže. Cesk Slov Neurol N 2013; 76/ 109(2): 207 – 210.
38. Johanson CE, Duncan JA 3rd, Klinge PM, Brinker T, Stopa EG, Silverberg GD. Multiplicity of cerebrospinal fluid functions: New challenges in health and disease. Cerebrospinal Fluid Res 2008; 5 : 10. doi: 10.1186/ 1743 - 8454 - 5 - 10.
39. Sosvorova L, Bestak J, Bicikova M, Mohapl M, Hill M, Kubatova J et al. Determination of homocysteine in cerebrospinal fluid as an indicator for surgery treatment in patients with hydrocefalus. Physiol Res 2014; 63(4): 521 – 527.
40. Jeppsson A, Zetterberg H, Blennow K, Wikkelsø C. Idiopathic normal ‑ pressure hydrocephalus: pathophysiology and diagnosis by CSF biomarkers. Neurology 2013; 80(15): 1385 – 1392. doi: 10.1212/ WNL.0b013e31828c2fda.
41. Lipina R, Reguli S, Novackova L, Podesvova H, Brichtova E. Relation between TGF‑beta 1 levels in cerebrospinal fluid and ETV outcome in premature newborns with posthemorrhagic hydrocephalus. Childs Nerv Syst 2010; 26(3): 333 – 341. doi: 10.1007/ s00381 - 009 - 1011 - 7.
42. Greenfield JP, Hoffman C, Kuo E, Christos PJ, Souweidane MM. Intraoperative assessment of endoscopic third ventriculostomy success. J Neurosurg Pediatr 2008; 2(5): 298 – 303. doi: 10.3171/ PED.2008.2.11.298.
43. Zohdi A, Ibrahim I. Variations in the site and size of third ventriculocisternostomy. Minim Invasive Neurosurg 1998; 41(4): 194 – 197.
44. Romero L, Ros B, Ibáñez G, Ríus F, González L, Arráez M.Endoscopic third ventriculostomy: can we predict success during surgery? Neurosurg Rev 2014; 37(1): 89 – 97. doi: 10.1007/ s10143 - 013 - 0494 - 6.
45. Kombogiorgas D, Sgouros S. Assessment of the influence of operative factors in the success of endoscopic third ventriculostomy in children. Childs Nerv Syst 2006; 22(10): 1256 – 1262.
46. Warf BC, Tracy S, Mugamba J. Long‑term outcome for endoscopic third ventriculostomy alone or in combination with choroid plexus cauterization for congenital aqueductal stenosis in African infants. J Neurosurg Pediatr 2012; 10(2): 108 – 111. doi: 10.3171/ 2012.4.PEDS1253.
47. Warf BC. Congenital idiopathic hydrocephalus of infancy: the results of treatment by endoscopic third ventriculostomy with or without choroid plexus cauterization and suggestions for how it works. Childs Nerv Syst 2013; 29(6): 935 – 940. doi: 10.1007/ s00381 - 013 - 2072 - 1.
48. Kamel MH, Kelleher M, Aquilina K, Lim C, Caird J, Kaar G. Use of a simple intraoperative hydrostatic pressure test to assess the relationship between mobility of the ventricular stoma and success of third ventriculostomy. J Neurosurg 2005; 103(5): 848 – 852.
49. Tabakow P, Czyz M, Szewczyk P, Weiser A, Jarmundowicz W. Usefulness of intraoperative magnetic resonance ventriculography during endoscopic third ventriculostomy. Neurosurgery 2013; 73(4): 730 – 738. doi: 10.1227/ NEU.0000000000000063.
50. Kulkarni AV, Hui S, Shams I, Donnelly R. Quality of life in obstructive hydrocephalus: endoscopic third ventriculostomy compared to cerebrospinal fluid shunt. Childs Nerv Syst 2010; 26 : 75 – 79. doi: 10.1007/ s00381 - 009 - 0983 - 7.
51. Roytowski D, Semple P, Padayachy L, Carara H. Intracranial pressure monitoring as an early predictor of third ventriculostomy outcome. World Neurosurg 2013; 80(5): 605 – 611. doi: 10.1016/ j.wneu.2013.01.129.
52. Cinalli G, Spennato P, Ruggiero C, Aliberti F, Zerah M, Trischitta V et al. Intracranial pressure monitoring and lumbar puncture after endoscopic third ventriculostomy in children. Neurosurgery 2006; 58(1): 126 – 136.
53. Ozisik P, Roth J, Beni ‑ Adani L, Constantini S. Continuous spinal drain following endoscopic third ventriculostomy: a proposal to change the definition of failure. Childs Nerv Syst 2011; 27(11): 1973 – 1978. doi: 10.1007/ s00381 - 011 - 1562 - 2.
54. Radovnický T, Vachata P, Sameš M. Telemetrický monitoring intrakraniálního tlaku v diagnostice hydrocefalu a nitrolební hypertenze. Cesk Slov Neurol N 2013; 76/ 109(6): 723 – 727.
55. Magnaes B. Hydromechanical testing in non‑communicating hydrocephalus to select patients for microsurgical third ventriculostomy. Br J Neurosurg 1989; 3(4): 443 – 450.
56. Tisell M, Edsbagge M, Stephensen H, Czosnyka M, Wikkelsø C. Elastance correlates with outcome after endoscopic third ventriculostomy in adults with hydrocephalus caused by primary aqueductal stenosis. Neurosurgery 2002; 50(1): 70 – 77.
57. Vajda Z, Büki A, Vetö F, Horváth Z, Sándor J, Dóczi T. Transcranial Doppler ‑ determined pulsatility index in the evaluation of endoscopic third ventriculostomy (preliminary data). Acta Neurochir (Wien) 1999; 141(3): 247 – 250.
58. Di Rocco F, Grevent D, Drake JM, Boddaert N, Puget S, Roujeau T et al. Changes in intracranial CSF distribution after ETV. Childs Nerv Syst 2012; 28(7): 997 – 1002. doi: 10.1007/ s00381 - 012 - 1752 - 6.
59. Kulkarni AV, Drake JM, Armstrong DC, Dirks PB. Imaging correlates of successful endoscopic third ventriculostomy. J Neurosurg 2000; 92(6): 915 – 919.
60. Schwartz TH, Ho B, Prestigiacomo CJ. Ventricular volume following third ventriculostomy. J Neurosurg 1999; 91(1): 20 – 25.
61. Schwartz TH, Yoon SS, Cutruzzola FW, Goodman RR. Third ventriculostomy: post‑operative ventricular size and outcome. Minim Invasive Neurosurg 1996; 39(4): 122 – 129.
62. Bargallo N, Olondo L, Garcia AI, Capurro S, Caral L, Rumia J. Functional analysis of third ventriculostomy patency by quantification of CSF stroke volume by using cine phase ‑ contrast MR imaging. AJNR Am J Neuroradiol 2005; 26(10): 2514 – 2521.
63. Lev S, Bhadelia RA, Estin D, Heilman CB, Wolpert SM. Functional analysis of third ventriculostomy patency with phase ‑ contrast MRI velocity measurements. Neuroradiology 1997; 39(3): 175 – 179.
64. O’Hayon BB, Drake JM, Ossip MG, Tuli S, Clarke M. Frontal and occipital horn ratio: a linear estimate of ventricular size for multiple imaging modalities in pediatric hydrocephalus. Pediatr Neurosurg 1999; 29(5): 245 – 249.
65. Pindrik J, Jallo GI, Ahn ES. Changes in third ventricular size in pediatric patients undergoing endoscopic third ventriculostomy. Childs Nerv Syst 2013; 29(11): 2027 – 2034.
66. Buxton N, Turner B, Ramli N, Vloeberghs M. Changes in third ventricular size with neuroendoscopic third ventriculostomy: a blinded study. J Neurol Neurosurg Psychiatry 2002; 72(3): 385 – 387.
67. Bouras T, Sgouros S. Complications of endoscopic third ventriculostomy. J Neurosurg Pediatr 2011; 7(6): 643 – 649. doi: 10.3171/ 2011.4.PEDS10503.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Projekt ncRNAPainČlánek Webové okénko
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2015 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Experimentální léčba poranění míchy
- Význam magnetické rezonance v diagnostice epilepsie
- Možnosti sledování a hodnocení kvality života u dětí a dospívajících s epilepsií ve světě a v České republice
- Prionový protein, jeho úloha v buněčné proliferaci, diferenciaci a vývoji nervové soustavy
- Předpověď úspěšnosti a selhání endoskopické ventrikulocisternostomie III. komory
- Změny efektivní konektivity po facilitační fyzioterapii u roztroušené sklerózy mozkomíšní
- Projekt ncRNAPain
- Snížení rizika vzniku mozkového infarktu v průběhu kardiochirurgické operace pomocí sonolýzy – pilotní výsledky
- Zachování sluchu při mikrochirurgické léčbě vestibulárního schwannomu
- Validace české verze komplexního protokolu kvantitativního testování senzitivity
- Neurologické syndromy sdružené s protilátkami proti membránovým a synaptickým antigenům
- Léčba pudendální neuralgie – klinické zkušenosti po pěti letech
- Syndrom Freyové (aurikulotemporální syndrom) po parotidektomii a jeho prevence
- Léčba foraminálního výhřezu meziobratlové ploténky u istmické spondylolistézy technikou TLIF
- Úspěšná léčba anti‑MAG neuropatie asociované s monoklonální gamapatií nejistého významu kombinací rituximabu s dexametazonem – kazuistika
- Žilní trombóza jako komplikace ventrikuloatriálního shuntu – kazuistika
- Spinocerebelární ataxie typu 6 – kazuistika
- Diastematomyelie u dospělých – kazuistika
- Webové okénko
-
Analýza dat v neurologii
LII. Odhad poměru šancí u složitějších tabulek četností
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba pudendální neuralgie – klinické zkušenosti po pěti letech
- Význam magnetické rezonance v diagnostice epilepsie
- Experimentální léčba poranění míchy
- Léčba foraminálního výhřezu meziobratlové ploténky u istmické spondylolistézy technikou TLIF
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



